已知反应:①Al+Fe2O3 Al2O3+Fe △H=a kJ/mol
Al2O3+Fe △H=a kJ/mol
②101kPa时,2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol
③稀溶液中,H+(aq)+OH-(aq)=H2O(1)△H=-57.3 kJ/mol
④红磷的化学式为P,白磷的化学式为P4,已知:P4(s)+5O2(g)=P4O10(s) △H=-3093.2 kJ/mol 4P (s)+5O2(g)=P4O10(s) △H=-2954.0 kJ/mol 下列结论正确的是
| A.铝热反应在高温下才能发生,因此a>0 |
| B.碳的燃烧热等于110.5 kJ/mol |
| C.稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量小于57.3 kJ |
| D.由条件可知:红磷转化为白磷是放热反应,所以等质量的红磷能量比白磷低 |
下列说法不正确的是
| A.化学反应除了生成新物质外,还伴随着能量的变化 |
| B.对于ΔH>0的反应,反应物的能量小于生成物的能量 |
| C.放热反应都不需要加热就能发生 |
| D.吸热反应在一定条件(如常温、加热等)下也能发生 |
对于0.1 mol·L-1Na2SO3溶液,正确的是
| A.升高温度,溶液pH降低 |
| B.c(Na+)=2c(SO32—)+c(HSO3—)+c(H2SO3) |
| C.c(Na+)+c(H+)=2c(SO32—)+2c(HSO3—)+c(OH-) |
| D.加入少量NaOH固体,c(SO32—)与c(Na+)均增大 |
下图中X、Y分别是直流电源的两极,通电后发现a电极质量增加,b电极处有无色无味气体放出。符合这一情况的是表中的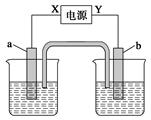
 |
a |
b |
X |
溶液 |
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |
“ZEBRA”蓄电池的结构如图所示,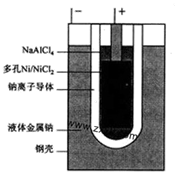
电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是
| A.电池反应中有NaCl生成 |
| B.电池的总反应是金属钠还原三个铝离子 |
| C.正极反应为:NiCl2+2e-=Ni+2Cl- |
| D.钠离子通过钠离子导体在两电极间移动 |
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是 
| A.电池的负极反应为Mg-2e-===Mg2+ |
| B.电池工作时,H+向负极移动 |
| C.电池工作一段时间后,溶液的pH增大 |
| D.电池总反应式是Mg+H2O2+2H+===Mg2++2H2O |