T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示,3分钟时达到平衡;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。 
(1)容器中发生的反应可表示为______ ________ ________ __
(2)该反应的△H 0(填“>”、“<”或“=”)
判断理由是:______ ________ ________ ________ ____ ________ __。
(3)反应进行的前3 min内,用X表示的反应速率 v(X)=____________
(4)保持其他条件不变,升高温度,该反应的化学平衡常数K将____________(填“变大”、“减小”或“不变”)
(5)①若改变反应条件,使反应进程如图3所示,则改变的条件是____________
②一定条件下的密闭容器中,该反应达到平衡,要提高气体Y的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.增加X的浓度 d.增加气体Y的浓度
市售的漂粉精的有效成分是,它在潮湿的空气里,发生化学反应的方程式是,写出工业上制取漂粉精的化学方程式:。将氯气制成漂粉精的主要目的是:。
0.3 mol的氧气和0.2 mol的臭氧(O3),(1)它们的质量比,
(2)它们所含的分子数比,
(3)它们所含的原子数比,
(4)它们同温同压时的体积比是。
根据下列几种粒子的结构示意图,回答问题:(填元素符号或离子符号)
(1)其中属于阴离子的是,
(2)属于金属元素的是,
(3)具有相似化学性质的是.
人们认识原子结构经历了古典原子论、近代原子论、模型、模型和现代原子论等几个阶段。
有FeCl3和AlCl3的混合溶液100ml,向其中加入过量的NaOH溶液,充分反应后,过滤,干燥,共生成沉淀10.7g。
(1)写出混合溶液中加入过量NaOH溶液的离子方程式、;
(2)将10.7g沉淀加热灼烧,最后得到固体克;
(3)FeCl3的物质的量的浓度是mol/L;
(4)在加入NaOH溶液的过程中,生成沉淀的质量与加入NaOH溶液的体积如下图所示,计算AlCl3的物质的量的浓度mol/L;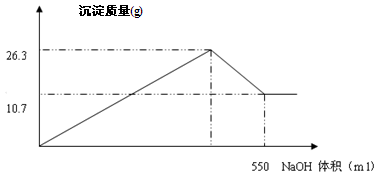
(5)求NaOH溶液的物质的量浓度?(提示:请写出第(5)小题的解题过程)