可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应①Br2 + 2e- = 2Br-
②2Br--2e- = Br2 ③Zn – 2e- = Zn2+ ④Zn2+ + 2e- = Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是
| A.②和③ | B.②和① | C.③和① | D.④和① |
关于下列说法正确的是
| A.乙醇、乙酸和甲醛广泛应用于食品加工 |
| B.分馏、干馏是物理变化,裂化、裂解是化学变化 |
| C.淀粉、蛋白质、植物油都是高分子化合物 |
| D.天然气、石油和核能都是不可再生能源 |
两会期间李克强总理在政府工作报告中指出要大力对环境进行保护和治理。下列有关说法中,错误的是
| A.新农村建设中富含氮、磷的废水可排放到河流、湖泊中,有利于淡水养殖 |
| B.工业废物和生活垃圾资源化利用,积极发展循环经济,有利于节能减排 |
| C.推广新能源汽车,治理机动车尾气,有助于突破“十面霾伏” |
| D.大力发展风电、水电、光伏发电,符合低碳理念 |
下列说法不正确的是
| A.德国化学家维勒用氰酸铵合成了尿素,打破了有机物与无机物的界限 |
| B.根据核磁共振谱的分析能得到有机物的相对分子质量 |
| C.分析红外光谱图可以初步判断有机物中具有哪些基团 |
| D.同位素示踪法可以用来确定有机反应中化学键的断裂位置 |
有如下合成路线,甲经二步转化为丙,下列叙述不正确的是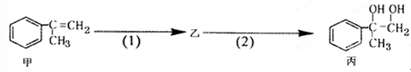
| A.丙中可能含有未反应的甲,可用溴水检验是否含甲 |
| B.反应(1)的无机试剂是液溴,铁作催化剂 |
| C.甲和丙均可与酸性KMnO4溶液发生反应 |
| D.反应(2)反应属于取代反应 |
已知某有机物的相对分子质量为70,且红外光谱表征到C=C和C=O的存在,1H核磁共振谱如下图(峰面积之比依次为1:1:1:3),下列说法正确的是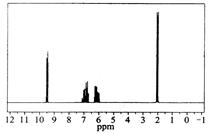
| A.分子中共有5种化学环境不同的氢原子 |
| B.该物质的分子式为C4H8O |
| C.该有机物的结构简式为CH3CH=CHCHO |
| D.在一定条件下,1mol该有机物可与3mol的氢气加成 |