准确量取25.00毫升高锰酸钾溶液,可选用的仪器是
| A.50 mL量筒 | B.25 mL量筒 |
| C.50 mL碱式滴定管 | D.50 mL酸式滴定管 |
在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体ICl,ICl有很强的氧化性。现有下列两个反应:①2ICl+2Zn= ZnCl2+ZnI2;②ICl+H2O=HCl+HIO。下列关于ICl性质的叙述正确的是
| A.反应①中,当转移0.4mol电子时生成13.6gZnCl2; |
| B.反应①中,ZnCl2是氧化产物,ZnI2是还原产物 |
| C.反应①中,ZnCl2既是氧化产物又是还原产物; |
| D.反应②中,ICl既是氧化剂又是还原剂 |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
| A.至少存在5种离子 |
| B.Cl-一定存在,且c(Cl-)≥0.4mol/L |
| C.SO42-、NH4+、一定存在,Cl-可能不存在 |
| D.CO32-、Al3+一定不存在,K+可能存在 |
现有m molNO2和n mol NO组成的混合气体,欲用a mol/L NaOH溶液使该混合气体全部转化成盐NaNO3或NaNO2进入溶液,需用该NaOH溶液的体积是
| A.m/a L | B.2m/3a L | C.2(m+n)/3a L | D.(m+n)/a L |
Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3均无剩余。为中和过量的H2SO4,并使FeSO4全部转化为Fe(OH)2沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4的物质的量浓度为
| A.2.25mol/L | B.2mol/L | C.0.3mol/L | D.0.6mol/L |
A、B、C、M是四种中学化学常见的物质,它们之间的转化关系如下图所示,A和M不可能是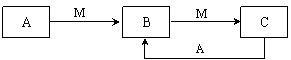
A.NaAlO2溶液和盐酸 B.Fe和Cl2C.SO2和NaOH溶液 D.NH3和O2