世界卫生组织早就把铝列为食品污染源之一,每人每日的摄入量控制在0.004g以下。若在1Kg米面食品中加入明矾2g(明矾的化学式为KAl(SO4)2·12H2O,相对分子质量为474),请回答下列问题:
(1) 人从食物中摄入的铝指的是_________(填字母)。
| A.铝元素 | B.铝单质 | C.铝合金 | D.只有明矾 |
(2) 明矾中铝元素的质量分数为(计算结果精确到0.1%)_______.
(3)如果某人一天吃了100上述米面食品,通过计算说明其摄入的铝的量是否超过安全摄入量?
某硫酸厂废水中含有少量硫酸.排放前,技术员小张先对废水中硫酸的含量进行检测。
(1)配制溶液:
欲配制溶质质量分数为4%的NaOH溶液100g,需要NaOH固体g,水ml
(水的密度为1 g/CI113);
(2)检测分析:
取废水样品98g,向其中逐滴加入NaOH溶液至恰好完全反应时,消耗4%的NaOH
溶液20g(假设废水中其它成分均不和NaOH反应)。试计算废水中硫酸的质量分数
(写出计算过程)。
(6分)为测定Cu一Zn合金的组成,小华同学利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关实验数据记录如下:
| 第一次 |
第二次 |
第三次 |
|
| 所取合金的质量/g |
1O |
10 |
20 |
| 加入硫酸的质量/g |
50 |
80 |
50 |
| 生成氢气的质量/g |
0.2 |
0.2 |
0.2 |
请计算:
(1)从上表数据分析,当所取合金与所用稀硫酸的质量比为时,表明合金中的锌与稀硫酸恰好完全反应;
(2)该合金中锌的质量为多少克?(计算结果保留一位小数)
(3)所用合金中的锌与稀硫酸恰好完全反应时所得溶液中溶质的质量分数为多少?(计算结果精确到0.1%)
(4分)今年兰州新区将加大生态林建设和城市绿化力度,着力改善新区生态环境。为此将推广种植3000亩薰衣草。以薰衣草为主要原料的薰衣助眠茶因富含挥发油、香豆素、单宁、类黄酮等而具有极高药用价值。已知香豆索的化学式为CxH602,相对分子质量为146,碳元素质量分数为74.0%。请回答:
(1)香豆素的化学式中x的数值是;
(2)香豆素中碳元素和氢元素的质量比为;
(3)含21.6g碳元素的香豆素的质量为g(计算结果保留一位小数)。
实验室测定一瓶稀硫酸中溶质的质量分数。取10g该待测液,向其中逐滴加入5%的NaOH溶液,加入NaOH溶液的质量与溶液pH的变化关系如图所示。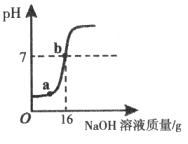
(1)16g 5%的NaOH溶液中所含溶质的质量是________g。
(2)a点对应溶液中的溶质是________________。
(3)计算待测稀硫酸中溶质的质量分数(写出计算过程及结果)。
某医生为病人输液时,使用的是0.9%的生理盐水,若某病人输液1000g,则进入病人体内的NaCl的质量为多少克?若用50g溶质质量分数为18%的NaCl溶液配制0.9%的生理盐水,需要水的质量是多少?