已知5%氨水的密度为0.98g/cm,25%氨水的密度为0.91g/cm,若将上述两溶液等体积混合,所得氨水溶液的质量分数是
| A.等于15% | B.大于15% | C.小于15% | D.无法估计 |
读下列药品标签,有关分析不正确的是( )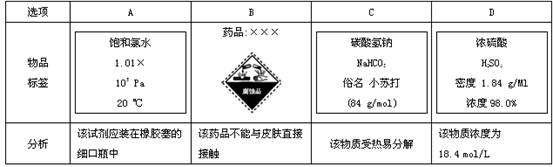
下列说法中正确的是 ()
| A.工业生产中用乙醇与氢氧化钠固体作用生成乙醇钠,反应生成水对乙醇钠的生成没有影响 |
| B.氯气与甲烷在光照下的取代反应历程为:光照下,甲烷分子失去一个H·同时生成·CH3,之后·CH3再与Cl2碰撞夺得氯原子成CH3Cl,生成氯自由基(Cl·) |
C.瘦肉精学名盐酸克伦特罗,结构如下图,可以发生取代、加成、水解、酯化、消去反应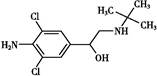 |
| D.苯丙烯的同分异构体(不包括顺反异构,除苯环外没有其他环)共有8种 |
绿藻的胶质中分离出一种有机化合物(用A表示),结构如图所示,A对人体无害,可用于新鲜食品中对脂肪酶进行抑制来保持风味,也可外用使伤口快速愈合。则关于该物质的说法中错误的有()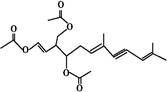
| A.该物质的化学式为C21H26O6 |
| B.该物质中含有两个手性碳原子 |
| C.1 mol 该物质最多能消耗5 mol H2和3 mol NaOH |
| D.该物质能发生加成反应、取代反应、氧化反应 |
有机物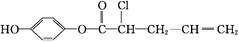 能够发生的反应有()
能够发生的反应有()
①加成反应;②取代反应;③消去反应;④氧化反应;⑤水解反应
| A.除②外 | B.除③外 | C.除④外 | D.全部 |
2012年4月18日沈阳和平区查获“毒豆芽”,其中添加一种动物用药恩诺沙星,其分子结构如图所示,下列有关恩诺沙星的说法中不正确的是()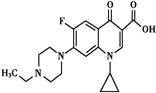
| A.本品不溶于水,微溶于甲醇,可溶于酸和碱 |
| B.分子式为C19H22FN3O3 |
| C.该物质的一氯代物共有9种 |
| D.该物质能发生酯化、加成、氧化、硝化、缩聚反应 |