氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C 2AlN+3CO,下列叙述正确的是
2AlN+3CO,下列叙述正确的是
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为-3价 |
| D.氮化铝晶体属于分子晶体 |
下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+)=c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +2c(OH-)=2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
盆烯是近年合成的一种有机物,它的分子结构可简化表示为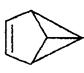 (其中C、H原子已略去),下列关于盆烯的说法中错误的是
(其中C、H原子已略去),下列关于盆烯的说法中错误的是
A.盆烯是乙烯的一种同系物
B.盆烯分子中所有的碳原子不可能在同一平面上
C.盆烯是苯的一种同分异构体
D.盆烯在一定条件下可以发生加成反应
下列实验操作中正确的是
| A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 |
| D.萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 |
用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L 气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为
| A.3 mol·L-1 | B.2 mol·L-1 | C.1 mol·L-1 | D.4 mol·L-1 |
在一恒容真空密闭容器,通入2molPCl3和2molCl2,加热到200℃时发生了反应: PCl5(g) PCl3(g)+Cl2(g),达到平衡时,PCl5有0.4mol,如果此时移走1molPCl3和1molCl2,再次达到质的量是
PCl3(g)+Cl2(g),达到平衡时,PCl5有0.4mol,如果此时移走1molPCl3和1molCl2,再次达到质的量是
| A.小于0.2mol | B.0.2mol |
| C.0.4mol | D.0.2mol和0.4mol之间 |