[2012·北京丰台一模]根据碘与氢气反应的热化学方程式,下列判断正确的是( )
① I2(g)+H2(g)  2HI(g) △H=-9.48 kJ·mol-1
2HI(g) △H=-9.48 kJ·mol-1
② I2(s)+H2(g)  2HI(g) △H=+26.48 kJ·mol-1
2HI(g) △H=+26.48 kJ·mol-1
| A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ |
| B.当反应②吸收52.96kJ热量时转移2mole一 |
| C.反应②的反应物总能量比反应①的反应物总能量低 |
| D.1 mol固态碘与1 mol气态碘所含能量相差17.00 kJ |
反应Fe(s)+CO2(g) FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是
FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是
| A.升高温度该反应的正反应速率增大,逆反应速率减小 |
B.该反应的化学平衡常数表达式为K= |
| C.该反应的正反应是吸热反应 |
| D.增大CO2浓度,平衡常数增大 |
在密闭容器中进行反应:X2(g)+Y2(g)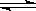 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
| A.Z为0.3 mol·L-1 | B.Y2为0.4 mol·L-1 |
| C.X2为0.2 mol·L-1 | D.Z为0.4 mol·L-1 |
对反应A+B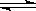 AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol
②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL
④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是
A.②>①>④>③ B.④>③>②>①
C.①>②>④>③ D.①>②>③>④
现用0.10 mol·L-1HCl溶液滴定10 mL 0.05 mol·L-1NaOH溶液,若酸式滴定管未润洗,达到终点时所用盐酸的体积应是
| A.10 mL | B.5 mL | C.小于5 mL | D.大于5 mL |
对于可逆反应A(g)+3B(s)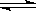 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.v(A)=0.5 mol·L-1·min-1
B.v(B)=1.2 mol·L-1·s-1
C.v(D)=0.4 mol·L-1·min-1
D.v(C)=0.1 mol·L-1·s-1