[2012·广东肇庆市一模]I:某兴趣小组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如下图实验装置。请回答:
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ;
C中反应的离子方程式为 。
(2)为了实现绿色环保的目标,某同学设计了上图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是 (写两点)。
II:用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。请回答:
(3)氨水吸收过量SO2的反应的离子方程式为 。
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 |
预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 |
若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 |
。 |
| 步骤3: 。 |
。 |
(9分)实验室用氯化钠固体配制100mL 1.0 mol·L-1的NaCl溶液,有如下操作步骤:
①用托盘天平称量____________g NaCl晶体放入小烧杯中,加适量蒸馏水溶解;
②继续向容 量瓶中加蒸馏水至液面距刻度线1-2cm处,改用_____________小心滴加蒸馏水至溶液凹液面的最低处与刻度线相切;
量瓶中加蒸馏水至液面距刻度线1-2cm处,改用_____________小心滴加蒸馏水至溶液凹液面的最低处与刻度线相切;
③把①中所得溶液小心地转入______________中;
④将容量瓶塞紧,充分摇匀;
⑤用少量蒸馏水洗涤烧杯与玻璃棒2-3次,洗涤液一并转移到容量瓶中。
(1)将上述步骤的空白处填空;
(2)本实验操作步骤的正确顺序是(填序号,不能重复);
(3)试分析下列操作对所配得溶液的浓度有何影响(填:“偏高”、“偏低”、或“无影响”)
①容量瓶用蒸馏水洗净后没有干燥就直接用来配溶液,所配得溶液的浓度;
②定容时,俯视刻度线,所配得溶液的浓度;
③定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。所配得溶液的浓度。
某学生用0.1×10×25mm3,质量分数≥99.5%的铝片和盐酸反应制取H2,实验现象见下表: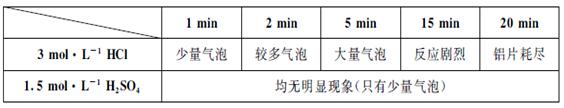
(1)写出铝片与盐酸、硫酸反应的离子方程式
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,15~20min内,反应速率逐渐减小。其原因是
(3)①根据铝片与盐酸和硫酸反应现象的差异,有学生对此现象提出如下猜想(至少要写出两种假设):
假设一:Cl-对该反应有促进作用,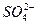 对该反应不影响。
对该反应不影响。
假设二:。
假设三:。]
假设四:。
③请你以“假设一”为实验课题,设计实验方案探究,要求写 出主要实验步骤。
出主要实验步骤。
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。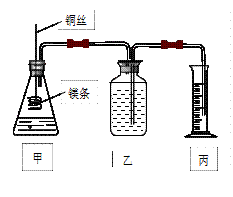
图1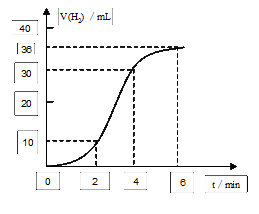
图2
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
|
在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:_______________________________________________________
_________________________________________________________。 率是否变化。
率是否变化。
 论:Cl-对反应具有加速作用。
论:Cl-对反应具有加速作用。
如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液.在F极附近显红色。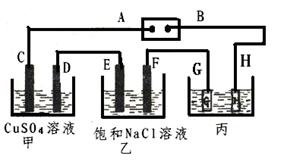
试回答以下问题:
(1)电极A的名称是。
(2)甲装置中D电极的电极反应式: ______________________________。
(3) 在25℃时若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生5.6L(标准状况下)一种气体,电解后溶液体积为50L时,求所得溶液在25℃时的氢氧化钠物质的量浓度=________。
(4)欲用丙装置给铜镀银,G应该是____(填“银”或“铜”),电镀液的主要成分是(填化学式)。
实验室里需要纯净的氯化钠溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案。请回答下列问题。
(1)操作①可选择__________仪器。
(2)试剂1为__________(填化学式)
(3)加入试剂2的目的________________,此时发生反应的离子方程式:______________。
(4)加入盐酸时,所发生反应的离子方程式:_________________________________。