[2012·潍坊高三期末] (1)下面a~f是中学化学实验中常见的几种玻璃仪器:
a.烧杯 b.容量瓶 c.试管 d.量筒 e.滴定管 f.圆底烧瓶
①其中标出仪器使用温度的是________(填编号,下同);
②使用前要检查仪器是否漏液的是________;
③可作反应容器并可直接加热的是________。
(2)化学是一门以实验为基础的科学,化学实验是学习的重要内容。根据你掌握的知识,判断下列描述正确的是 (填序号)。
| A.将一块pH试纸浸入稀盐酸中,测定溶液pH |
| B.用25mL酸式滴定管量取18.80mLKMnO4溶液 |
| C.用苯萃取碘水中的I2时,有机层从分液漏斗的上口倒出 |
| D.各放一张质量相同的滤纸于天平的两盘上,将NaOH固体放在左盘纸上称量 |
E.某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体,则该钾盐为K2CO3
F.向某溶液中加入Ba(NO3)2溶液有白色沉淀产生,加盐酸沉淀不消失,则原溶液中一定含有SO42-
在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
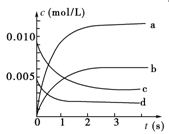
(1)写出该反应的平衡常数表达式:K=________。已知:K300 ℃>K350 ℃,则该反应是________热反应。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向逆反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g)  2NH3(g);ΔH =" -92.2" kJ·mol-1。
2NH3(g);ΔH =" -92.2" kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t2﹑t4﹑t5﹑t7时刻所对应的实验条件改变分别是
t2t4t5t7。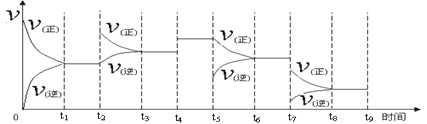
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为。
(2)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入1mol及2mol碘化氢待反应:2HI(g) H2(g)+I2(g)达到平衡后,平衡时I2的浓度c(I2)Ac(I2)B;平衡时HI的分解率αAαB;平衡时H2在混合气体中的体积分数AB (填写“>”“<”“=”)
H2(g)+I2(g)达到平衡后,平衡时I2的浓度c(I2)Ac(I2)B;平衡时HI的分解率αAαB;平衡时H2在混合气体中的体积分数AB (填写“>”“<”“=”)
⑴ 现有0.1mol·l-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作。
⑵ 欲使0.1mol-1Na2CO3溶液中c(Na+)=2 c(CO32-),应采取的措施是()
A.加少量盐酸 B.加适量的KOH C.加适量的水 D.加适量的NaOH
⑶ 为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是()
A.甲同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。
B.乙同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。
C.丙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。
D.丁同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。
⑷ 为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案。
下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
KW |
1×10-12 |
试回答以下问题:
(1)若25℃<t1<t2,则KW__________1×10-14(填“>”、“<”或“=”),判断的理由是。
(2)25℃下,将pH=13的氢氧化钠溶液V1 L与pH=1的稀盐酸V2 L混合(设混合后溶液的体积为:V1+V2),所得混合溶液的pH=2,则V1 : V2=__________。
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”、“中性”或“碱性”),溶液中c(Na+)c(CH3COO-)(填“>”、“=”或“<”)。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈性(填“酸”、 “中”或“碱”),溶液中c(Na+)c(CH3COO-)(填“>”、“=”或“<”)。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显性(填“酸”、“碱”或“中”)。
(1)写出下列物质在水溶液中的电离方程式:
NH3·H2O:, Ba(OH)2:___________________________,
HClO:, NaHCO3:___________________________ 。
(2)某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
①向溶液中加入适量NaA固体,以上平衡将向________(填“正”、“逆”)反应方向移动,溶液的PH________(“增大”“减小”“不变”)。
②若向溶液中加入适量水,以上平衡将向________(填“正”、“逆”、“不移动”)反应方向移动,溶液中c(A-)将________(填“增大”、“减小”或“不变”,下同),溶液中c(H+)将________,由水电离的的c(H+)将。
(3)等体积的下列溶液中,阳离子的总物质的量最大的是____________。
①0.2 mol·L-1的CuSO4溶液②0.1 mol·L-1的Na2CO3
③0.2 mol·L-1的KCl④0.1 mol·L-1的Na2SO4