某同学通过系列实验探讨Mg及其化合物的性质,操作正确且能达到目的的是( )
| A.将水加入浓硫酸中得稀硫酸,置镁片于其中探讨Mg的活泼性 |
| B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 |
| C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 |
| D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 |
2015年8月12日晚11时许,天津市塘沽开发区一带发生爆炸事故,现场火光冲天。据多位市民反映,事发时十公里范围内均有震感,抬头可见蘑菇云,安全问题再次敲响了警钟。下列关于安全问题的说法,不正确的是()
| A.危险化学品包括:爆炸品、易燃物质、自燃自热物质、氧化性气体、加压气体等 |
| B.金属钠着火不能用水灭火,应使用干砂灭火 |
| C.处置实验过程产生的剧毒药品废液,稀释后用大量水冲净 |
| D.简单辨认有味的化学药品时,将瓶口远离鼻子,用手在瓶口上方扇动,稍闻其味即可 |
室温时,向20 mL 0.1 mol/L醋酸溶液中不断滴入0.1 mol/L NaOH溶液,溶液pH变化曲线如图所示。下列关于溶液中离子浓度大小关系的描述正确的是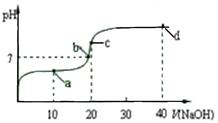
| A.a点时:c(CH3COOH) c(CH3COO-) c(H+) c(Na+) c(OH-) |
| B.b点时:c(Na+) c(CH3COO-) |
| C.c点时:c(H+)=c(CH3COOH)+c(OH-) |
| D.d点时:c(Na+) c(OH-) c(CH3COO-) c(H+) |
以下说法正确的是
①某溶液加入稀盐酸产生无色无味的气体,将气体通入澄清石灰水溶液变浑浊,则溶液中一定含有大量CO32-Na2CO3
②向饱和FeCl3溶液中滴加过量氨水制取Fe(OH)3胶体
③除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:BaCl2溶液→NaOH
溶液→Na2CO3溶液→过滤后加盐酸
④工业上常用铁质容器盛冷浓硫酸,因为浓硫酸有强氧化性,能使铁钝化阻止反应进一步进行
⑤实验室用图1所示装置制备并收集收集少量氨气
⑥实验室用图2所示装置除去Cl2中的少量HCl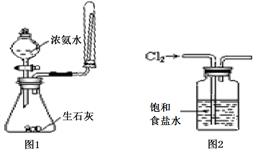
| A.③④⑥ | B.①②③ | C.④⑤⑥ | D.①③④⑤⑥⑩ |
下列图示与对应的叙述相符的是
A.由图甲可以判断:若T1>T2,反应A(g)+ B(g) 2C(g)的△H<0 2C(g)的△H<0 |
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 |
| D.图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化 |

阿司匹林是常见的解热镇痛药,结构简式如图所示,有关阿司匹林的说法正确的是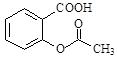
| A.能发生取代、酯化反应,但不能发生氧化、还原反应 |
| B.阿司匹林分子中最多可以有13个原子在同一平面上 |
| C.1 mol该物质完全氧化最多可消耗10 mol氧气 |
| D.1 mol该物质最多可与3 mol NaOH发生反应 |