[2012·泉州第二质检]有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的一种或几种。为确定其成分,进行如下实验:①取部分溶液,逐滴滴入NaOH溶液至过量,只观察到白色沉淀先增多后又部分溶解,无其它明显现象;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生。下列推断正确的是
| A.肯定有Al3+、Mg2+、Cl-,可能有K+ |
| B.肯定有Al3+、Mg2+、Cl-,可能有NH4+ |
| C.肯定有Al3+、Mg2+、HCO3-,肯定没有MnO4- |
| D.肯定有K+、Al3+、MnO4-,可能有HCO3- |
氧可与许多元素形成化合物,下列有关叙述错误的是
A.水分子的结构式为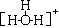 |
| B.氧与氟形成的化合物(OF2)中,氧元素的化合价为-2价 |
C.Na2O2的电子式为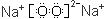 |
D.在MgO晶体中,阴离子的结构示意图可表示为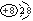 |
向一定量的Cu、Fe2O3的混合物中加入300mL 1mol/L的HCl溶液,恰好使混合物完全溶解,所得溶液中加入KSCN溶液后无红色出现,若用过量的CO在高温下还原相同质量的此混合物,固体的质量减少了()
| A.6.4g | B.4.8g | C.2.4g | D.1.6g |
在一定条件下,使CO和O2的混合气体26g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合物气体中O2和CO的质量比可能是()
| A.7︰6 | B.6︰7 | C.9︰4 | D.1︰1 |
向质量分数为2a%,体积为10mL,物质的量浓度为c1 mol·L-1的稀H2SO4中加入VmL的水,使之质量分数为a%,此时物质的量浓度为c2 mol·L-1,则下列关系正确的是()C
| A.V > 10mL 2c2=c1 | B.V < 10mL 2c2>c1 |
| C.V > 10mL 2c2<c1 | D.V > 10mL 2c2>c1 |
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
| 物质编号 |
物质转化关系 |
甲 |
乙 |
丙[ |
丁 |
| ① |
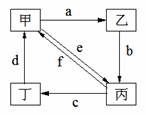 |
Cu[] |
CuO |
CuCl2 |
Cu(NO3)2[K] |
| ②[ |
Na2CO3 |
NaOH |
NaHCO3 |
CO2 |
|
| ③ |
(NH4)2SO3 |
CaSO3 |
SO2 |
NH4HSO3 |
|
| ④ |
Al(OH)3 |
Al2O3 |
NaAlO2 |
AlCl3 |
A.①②③ B.①③④ C.②④ D.①②③④