[2012·江苏卷] 废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收 Cu并制备ZnO的部分实验过程如下: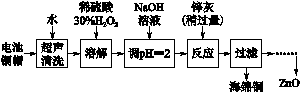
(2)①铜帽溶解时加入H2O2的目的是______ _____________________(用化学方程式表示)。
②铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法____ ___。
(3)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-===2CuI(白色)↓+I2
2S2O32-+I2===2I-+S4O62-
①滴定选用的指示剂为________,滴定终点观察到的现象____________________。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会________(填“偏高”、“偏低”或“ 不变”)。
已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| Zn2+ |
5.9 |
8.9 |
实验中可选用的试剂:30% H2O2、1.0 mol·L-1 HNO3、1.0 mol·L-1 NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为:
①____________________________________________________________;
②__________________________________________________________________;
③过滤;
④___________________________________________________________________;
⑤过滤、洗涤、干燥;
⑥900 ℃煅烧。
某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:
请根据题目要求回答下列问题:
(1)A的化学式为 。
(2)趁热过滤的目的是 。
(3)结晶操作过程中应控制滤液酸性的原因是 。
(4)实验室利用硫酸亚铁铵溶液[(NH4)2Fe(SO4)2]和草酸溶液反应生成草酸亚铁,草酸亚铁晶体(相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。
①该装置中最不合理的部分 (填字母),原因是 。
②改用正确装置开始实验,B处变蓝,说明草酸亚铁晶体中有 ;C处有白色沉淀,E处黑色粉末变为红色,说明草酸亚铁分解产生 (填化学式)。
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr  NaHSO4+HBr↑,CH3CH2OH+HBr
NaHSO4+HBr↑,CH3CH2OH+HBr CH3CH2Br+H2O。有关数据见下表:
CH3CH2Br+H2O。有关数据见下表:
| 乙醇 |
溴乙烷 |
溴 |
|
| 状态 |
无色液体 |
无色液体 |
深红色液体 |
| 密度/(g·cm-3) |
0.79 |
1.44 |
3.1 |
| 沸点/℃ |
78.5 |
38.4 |
59 |

(1)A装置的名称是 。
(2)实验中用滴液漏斗代替分液漏斗的优点为 。
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式 。
(4)给A加热的目的是 ,F接橡皮管导入稀NaOH溶液,其目的主要是 。
(5)图中C中的导管E的末端须在水面以下,其目的是 。
(6)为了除去产品中的主要杂质,最好选择下列__(选填序号)溶液来洗涤所得粗产品
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0 g。
①在上述提纯过程中每次分液时产品均从分液漏斗的_____________(上口或下口)取得。
②从乙醇的角度考虑,本实验所得溴乙烷的产率是______________。
无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐。
(1)实验室中可将FeCl3溶液 、 、过滤、洗涤干燥得FeCl3·6H2O;再 ,得到无水FeCl3。
(2)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:
①为抑制FeCl3水解,溶液X为 。
②上述流程中FeCl3能被异丙醚萃取,其原因是 ;检验萃取、分液后所得水层中是否含有Fe3+的方法是 。
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是 。
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于右图所示仪器 (填“甲”或“乙”)中;下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是 。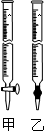
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质.某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解).
(1)实验原理
①Al4C3与硫酸反应可生成CH4,
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与过量NaOH溶液反应的化学方程式 ,
(2)实验装置(如图所示)
(3)实验过程
①连接实验装置,检验装置的气密性.称得D装置的质量为yg,滴定管的读数为amL.
②称取xg AlN样品置于装置B瓶中;塞好胶塞,关闭活塞 ,打开活塞 ,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应.
③待反应进行完全后,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与装置B瓶内物质充分反应.
④ (填入该步应进行的操作).
⑤记录滴定管的读数为bmL,称得D装置的质量为zg.
(4)数据分析(已知:该实验条件下的气体摩尔体积为Vm L•mol﹣1)
①Al4C3的质量分数为 .
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”).
③AlN的质量分数为 。
某化学兴趣小组利用某废弃的氧化铜锌矿制取活性ZnO,实验流程如下:
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)__________ Ksp(ZnS)(选填“>”“<”或“=”).
(2)甲、乙两同学选用下列仪器,采用不同的方法制取氨气。
①甲同学使用的药品是熟石灰与氯化铵,则应选用装置__________(填写装置代号)
②乙同学选用了装置B,则使用的两种药品的名称为_________。
(3)沉淀过程需降温冷却的原因为 、 。
(4)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂--K2FeO4,写出该反应的离子方程式 。