Al、Fe、Cu都是重要的金属元素。下列说法正确的是( )
| A.三者对应的氧化物均为碱性氧化物 |
| B.三者的单质放置在空气中均只生成氧化物 |
| C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
下列各化合物中,能发生酯化、还原、加成、消去四种反应的是
| A.CH3—CH(OH)—CH2—CHO |
| B.CH2(OH)—CH(OH)—CH(OH)—CH3 |
| C.CH3—CH=CH—CHO |
| D.HOCH2COCH2CHO |
下列各组中两个变化所发生的反应,属于同一类型的是
①由乙醇制乙醛、由溴乙烷制乙烯
②乙烯使溴的四氯化碳溶液褪色、苯酚使溴水褪色
③由乙烯制聚乙烯、由异戊二烯制聚异戊二烯
④由油脂制肥皂、由淀粉制葡萄糖
| A.只有②③ | B.只有③④ | C.只有①③ | D.只有①④ |
由 、
、 、
、 、
、 四种原子团(前两者为含苯环的基团)组成属于酚类物质的种类有
四种原子团(前两者为含苯环的基团)组成属于酚类物质的种类有
| A.1种 | B.2种 | C.3种 | D.4种 |
下列叙述正确的是
①用植物纤维制造出的机动车燃料,属清洁的可再生能源
②可用甲醛溶液浸泡海产品,使海产品保鲜
③变质的油脂有难闻的刺激气味,是由于油脂发生了水解反应
④蜂蚊叮咬人的皮肤时将分泌物注入人体,此时可在患处涂抹小苏打溶液或稀氨水
⑤提倡在生活中不用塑料袋,是为了防止白色污染
| A.①④⑤ | B.②③④ |
| C.①③⑤ | D.①②③④⑤ |
下列说法不正确的是
| A.麦芽糖及其水解产物均能发生银镜反应 |
| B.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| C.花生油既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 |
D.用甘氨酸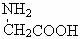 和丙氨酸 和丙氨酸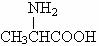 缩合最多可形成4种二肽 缩合最多可形成4种二肽 |