[2012·漳州质检]2012年1月,广西河池龙江河段检测出重金属镉离子(Cd2+)含量超标,当地政府积极展开治污工作。聚合氯化铝可以将离子状态的镉固化,这是当前可采取治理镉污染的最有效方法。
已知:①煤矸石是煤矿在洗煤和选煤过程中大量排出的固体废弃物,煤矸石主要含Al2O3、SiO2及铁的氧化物。
②聚合氯化铝([Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂。
以煤矸石为原料,采用铝盐水解絮凝剂,制得聚合氯化铝的工艺流程如下:
回答下列相关问题:
(1)向反应器中加入混合酸(20%的硫酸和盐酸)酸浸,其目的是 。
(2)流程中残渣1可用于工业上制取粗硅,写出该反应的化学方程式 。
(3)流程中残渣2的主要成分是 ,确认该成分中阳离子的方法是 。
(4)聚合氯化铝除镉的原理是生成了氢氧化铝胶体吸附镉离子,确定已生成氢氧化铝胶体的方法可利用胶体性质中的 。
常温下以溶液pH为横坐标,Cd2+离子的除去率为纵坐标,实验结果如图所示,由图可知,Cd2+离子的除去率最高时,溶液的c(OH-)= 。
(10分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行探究:
Ⅰ、查阅资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅱ、牙膏样品中碳酸钙的定量测定:
利用下图所示装置(图中夹持仪器略去)进行实验,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。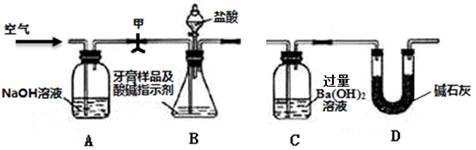
实验步骤:
如上图所示连接好装置,先检查装置的气密性;
准确称取牙膏样品的质量4.00g,并在各仪器中加入相应试剂;
打开弹簧夹甲,缓缓通入空气,然后接上C;
打开B的分液漏斗滴加盐酸反应,同时再次持续缓缓通入空气;
待B中不再产生气体后停止滴加盐酸;
将C中沉淀过滤、洗涤、干燥,得BaCO3;
称量BaCO3的质量为1.97g。
依据实验过程回答下列问题:
(1)步骤④通过空气的作用有:________________、_____________。
(2)步骤⑥中检验沉淀洗干净的方法是。
(3)本实验测定得到的样品中碳酸钙的质量分数为。若采取下列措施,对测定结果的准确度没有影响的是_____________(填标号)。
a.省略步骤③ b.滴加盐酸快一些
c.在B、C之间增添盛有饱和NaHCO3溶液的洗气装置
d. 多次实验,取平均值计算
(4)有同学认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以准确测定碳酸钙的质量分数。请你说明是否可以并简要说明理由。
(12分) 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题: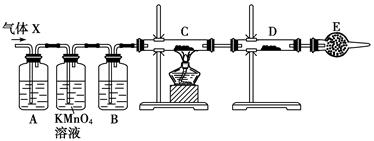
(1)上述反应中生成二氧化硫的化学方程式为_______________________________。
(2)乙同学认为还可能产生氢气的理由是_________________________________。
(3)丙同学在安装好装置后,必不可少的一步操作是_________________________。
(4)A中加入的试剂可能是,作用是_________________________________;
B中加入的试剂可能是,作用是___________________________________ ;
(5)可以证明气体X中含有氢气的实验现象是:
C中:,D中:________________________________________。
如果去掉装置B,还能否根据D中的现象判断气体X中有氢气? (填“能”或“不能”),原因是______________________________________
环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮: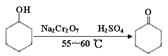
环己醇、环己酮和水的部分物理性质见下表:
| 物质 |
沸点(℃) |
密度(g·cm-3,20 ℃) |
溶解性 |
| 环己醇 |
161.1(97.8) |
0.9624 |
能溶于水 |
| 环己酮 |
155.6(95) |
0.9478 |
微溶于水 |
| 水 |
100.0 |
0.9982 |
括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。
实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55~60 ℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100 ℃的馏分,得到主要含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为。
②蒸馏不能分离环己酮和水的原因是。
(2)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151~156 ℃馏分
b.过滤
c.在收集到的馏分中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水
①上述操作的正确顺序是。(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需。
③在上述操作c中,加入NaCl固体的作用是。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有种不同化学环境的氢原子。
下图装置Ⅰ是实验室制乙酸乙酯的常用装置: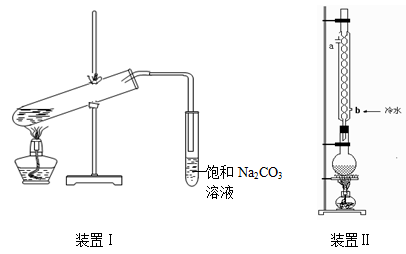
(装置1大试管口是否要加橡胶塞)
实验中所用的某些试剂及产物的相关数据如下: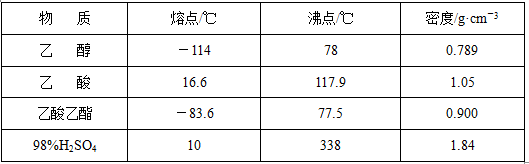
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式(在反应物和生成物中标出18O的位置),浓H2SO4的作用是。
(2)要从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入(填仪器名称),用力振荡,静置,(填现象),然后将产物从_____口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因:。
(7分)实验室制取硝基苯常用下图装置: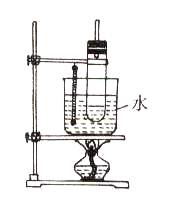
(1)苯的硝化反应是在浓H2SO4和浓HNO3的混合酸中进行的,混酸的添加顺序是先加后加。
(2)请写出该反应的方程式_______________________________。
(3) 被水浴加热的试管口部都要带一长导管,其作用是____________________________________
(4)苯的化学性质是易取代,那么除了苯的硝化反应外,你还能写出其他的取代反应方程式吗?请写出.