在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱。某纯碱生产厂制得的产品Na2CO3中混有少量NaHCO3。为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3 Na2CO3+CO2↑+H2O, Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示。
Na2CO3+CO2↑+H2O, Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示。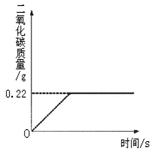
请解答下列问题:
(1)反应过程中生成二氧化碳的质量为 g
(2)100g混合物中NaHCO3的质量;
鸡蛋壳的主要成分是碳酸钙。某学生想测定鸡蛋壳中碳酸钙的质量分数,取15g干燥的碎鸡蛋壳放入烧杯中,向其中加入了40g稀盐酸恰好完全反应(假设鸡蛋壳中除碳酸钙外的其他成分都不溶于水,且不与稀盐酸反应),反应后烧杯中物质的总质量50.6g。计算鸡蛋壳中碳酸钙的质量分数(结果保留1位小数)。
某化工厂怀疑采购来的烧碱有部分变质,工厂技术员为了测定其变质情况,即测定烧碱的纯度(假设样品中只有氢氧化钠和碳酸钠这两种成分,且碳酸钠是变质产生的),做了如下实验:取烧碱样品20g,分四次加入到36.5g一定浓度的稀盐酸中,数据如下表所示
| 实验次数 |
1 |
2 |
3 |
4 |
| 每次加入样品的质量/g |
5 |
5 |
5 |
5 |
| 反应后剩余物质的总质量/g |
40.4 |
44.3 |
m |
54.3 |
请根据提供的数据,回答下列问题:
(1)表格中m的数值为。
(2)请计算烧碱样品中烧碱的纯度。
某研究性学习小组到超市买了一包碱面,包装袋上标明主要成分是碳酸钠,还含有少量的氯化钠。该兴趣小组为研究其成分,称取样品25.0g,将其配制成溶液,再向其中逐滴加入足量的溶质质量分数为14.6%的稀盐酸,反应生成二氧化碳的质量与所加入的稀盐酸质量关系如图。试回答下列问题: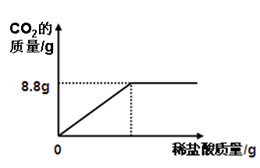
(1)样品充分反应后生成CO2的质量为g
(2)原固体中Na2CO3的质量分数是多少?(请写出计算过程)
(3)样品中碳酸钠与盐酸恰好完全反应时,消耗的稀盐酸的质量是_____________g
【交流反思】研究性学习小组的甲同学认为,要求出碳酸钠的质量,还可以使用与盐酸所属类别不同的其他物质,如________、______(填一种具体物质的化学式及该物质所属的类别)的溶液与样品反应,测定相关物质的质量,进行有关计算即可。
尿素的化学式为CO(NH2)2,试求:
(1)尿素的化学式量;
(2)尿素中C、O、N、H元素的质量比;
(3)尿素中N元素的质量分数(计算结果精确到0.1%);
(4)50kg尿素中氮元素的质量。
某钙片的标签如下,且知钙片成分中只有碳酸钙中含有钙元素:
(1)请计算碳酸钙中钙元素的质量分数为 ;
(2)请通过计算推断此标签中的含钙量是 (填虚假或真实)的;
(3)某实验小组为测定其真实的含钙量做了如下实验,每次取10片钙片放入已称量的含足量盐酸的烧杯中,发生的化学反应是:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑,充分反应后再称取烧杯和剩余物质的总质量,数据如下:
| 物质的质量 |
|
| 反应前:烧杯+盐酸 |
22g |
| 10片钙片 |
8g |
| 反应后:烧杯+剩余物 |
26.7g |
请计算此钙片中碳酸钙的质量分数。