(每空1分,共7分)某兴趣小组用石灰石和稀盐酸反应制取CO2,并验证CO2的性质。在确认装置气密行良好后进行实验。把制得的气体通入澄清石灰水中,发现石灰水没有变浑浊。对此展开探究:
(1)[提出问题]澄清石灰水为什么水没有变浑浊?
[猜想与验证]①甲同学认为可能澄清石灰水已变质。他取少量澄清石灰水于试管中,向其中吹气,现象是:__ ___,说明澄清石灰水没有变质。
②乙同学认为制得的CO2中可能有HCl气体。他作出此猜想的依据是_____________________,他用试管取少量紫色石蕊试液,再通入制得的气体,紫色石蕊试液变红,他得出结论是CO2中混有气体。
③丙同学认为乙同学的实验结论是错误的,理由是_________________________,请你帮助他们设计实验证明:
[实验验证]
| 实验步骤 |
实验现象 |
实验结论 |
| |
|
CO2中混有HCl气体 |
(2)反思与评价丁同学认为既然用稀盐酸制得的CO2不纯,为何不用H2SO4代替盐酸。请问丁同学的想法对吗?________;理由是_________________________________________。
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:
用电石浆可生产无水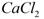 ,某化工厂设计了以下工艺流程:
,某化工厂设计了以下工艺流程: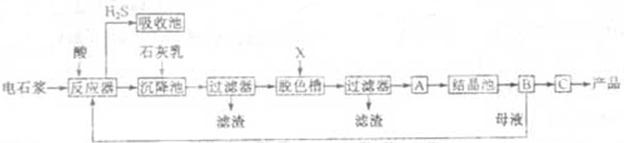
已知氯化钙晶体的化学式是: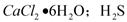 是一种酸性气体,且具有还原性。
是一种酸性气体,且具有还原性。
(1)反应器中加入的酸应选用 。
(2)脱色槽中应加入的物质X是;设备A的作用是;设备B的名称为 ④ ;设备C的作用是 ⑤。
(3)为了满足环保要求,需将废气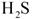 通入吸收池,下列物质中最适合作为吸收剂的是⑥。
通入吸收池,下列物质中最适合作为吸收剂的是⑥。
| A.水 | B.浓硫酸 | C.石灰乳 | D.硝酸 |
(4)将设备B中产生的母液重新引入反应器的目的是⑦。
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为、。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是,滤渣是;过滤操作②的滤液是和,滤渣是。
(3)工艺过程中③和④的目的是。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水中,用0.0500 mol•L-1的酸性KMnO4溶液滴定,至粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为;列式计算该成品的纯度。
硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下: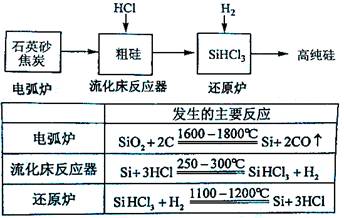
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为;碳化硅又称,其晶体结构与相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和。
| 物质 |
Si |
SiCl4 |
SiHCl3 |
SiH2Cl2 |
SiH3Cl |
HCl |
SiH4 |
| 沸点/℃ |
2355 |
57.6 |
31.8 |
8.2 |
-30.4 |
-84.9 |
-111.9 |
③SiHCl3极易水解,其完全水解的产物为。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是。
(2014届福建省莆田市高三3月质量检测化学试卷)
氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有趾Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)上图C装置中球形干燥管的作用是______________。
(2)完成以下实验步骤:组装好实验装置,首先____________,再加入实验药品。接下来的实验操作是______________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见___________。
【方案2】用右图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
(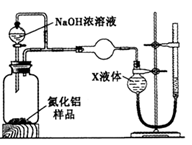
(4)为测定生成气体的体积,量气装置中的X液体可以是_________________________。
a.CCl4 b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AIN的质量分数__。
【方案3】按以下步骤测定样品中A1N的纯度:
(6)步骤②生成沉淀的离子方程式为___________________。
(7)若在步骤③中未洗涤,测定结果将__________(填“偏高”、“偏低”或“无影响”)。
(2014届甘肃河西五市部分普通高中高三第一次联合考试化学试卷)
图中是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先___ _____,在E中装入水,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生________(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________________________。
(4)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式:____________________,迅速产生倒吸的原因是____________________________。