在一容积可变的密闭容器中,通入1 mol X和3 mol Y,在一定条件下发生如下反应:X(g)+3Y(g)  2Z(g),到达平衡后,Y的体积分数为a%,然后再向容器中通入2 mol Z,保持在恒温恒压下反应,当达到新的平衡时,Y的体积分数为b%。则a与b的关系是
2Z(g),到达平衡后,Y的体积分数为a%,然后再向容器中通入2 mol Z,保持在恒温恒压下反应,当达到新的平衡时,Y的体积分数为b%。则a与b的关系是
| A.a=b | B.a>b | C.a<b | D.不能确定 |
酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液与乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此测定原理有关的是:()
①乙醇沸点低②乙醇密度比水小③乙醇有还原性④乙醇是烃的衍生物
| A.①③ | B.②③ | C.②④ | D.①④ |
下列离子方程式正确的是()
| A.甲酸与碳酸钠溶液反应:2H++CO32-== CO2↑+H2O |
| B.醋酸溶液与新制氢氧化铜反应: 2CH3COOH+Cu(OH)2  Cu2++2CH3COO-+2H2O Cu2++2CH3COO-+2H2O |
| C.苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O  2C6H5OH+CO32- 2C6H5OH+CO32- |
| D.甲醛溶液与足量的银氨溶液共热: |
HCHO+4[Ag(NH3)2]OH CO32-+2NH
CO32-+2NH +4Ag↓+6NH3+2H2O
+4Ag↓+6NH3+2H2O
受台湾“塑化剂污染食品”风波的影响,2011年6月1日卫生部紧急发布公告,将塑化剂列入食品中可能违法添加的非食用物质和易滥用的食品添加剂名单。已知塑化剂DEHP分子结构简式如下图。下列说法中不正确的是()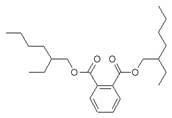
| A.DEHP是芳香族化合物 |
| B.DEHP是酯类物质 |
| C.DEHP分子中共有5个双键 |
| D.DEHP分子中至少有8个碳原子在同一平面 |
已知A物质的分子结构简式如图所示, l mol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为()
| A.6mol | B.7mol | C.8mo1 | D.9mo1 |
将 和C3H5(OH) 3(甘油)以一定比例混合,测得混合物含碳51.3%,那么氧元素的质量分数是()
和C3H5(OH) 3(甘油)以一定比例混合,测得混合物含碳51.3%,那么氧元素的质量分数是()
| A.40% | B.35% | C.30% | D.无法计算 |