下列有机化学方程式书写正确的是
A.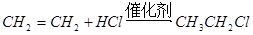 |
B.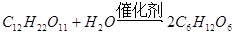 蔗糖葡萄糖 |
C.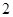  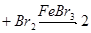  |
D. |
下列各化合物的命名中正确的是
| A.CH2=CH-CH=CH2 1,3—二丁烯 | B.CH3 –O –CH3乙醚 |
C.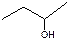 3―丁醇 3―丁醇 |
D.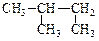 2―甲基丁烷 2―甲基丁烷 |
研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是
| A.蒸馏可用于分离提纯液态有机混合物 |
| B.燃烧法是研究确定有机物成分的一种有效方法 |
| C.核磁共振氢普通常用于分析有机物的相对分子质量 |
| D.对有机物分子红外光谱图的研究有助于确定有机物分子中的基团 |
2010年下半年,我国接连发生多起煤矿爆炸事故,造成重大人员伤亡和财产损失。煤矿发生爆炸事故的元凶是煤矿坑道气中含有的甲烷。下列关于甲烷的叙述中错误的是
| A.“抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸 |
| B.甲烷分子是一种呈正四面体型的分子 |
| C.甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 |
| D.甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子 |
某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入100mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:
| A.b≥40y(2-) | B.b≥8 0y(2-) 0y(2-) |
| C.b≥40y(1-) | D.b≥80y(1-) |
下列物质中的杂质(括号内为杂质)的检验、除杂的试剂或方法正确的是
| 物质及其杂质 |
检验 |
除杂 |
| A.Cl2(HCl) |
湿润的淀粉KI试纸 |
饱和食盐水 |
| B.NaHCO3溶液(Na2CO3) |
Ca(OH)2溶液 |
过量CO2 |
| C.CO2(HCl) |
AgNO3溶液(含稀硝酸) |
饱和Na2CO3溶液 |
| D. NO(NO2) |
观察颜色或湿润的淀粉KI试纸 |
水 |