A、B、C为三种短周期元素,A、B在同周期, A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中正确的是()
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
有关下列装置或操作说法错误的是()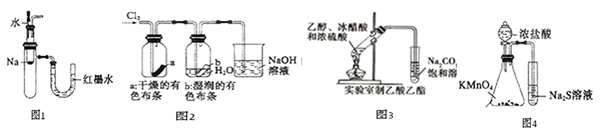
| A.图1中:将胶头滴管中的水滴入到金属钠中,能看到U型管右侧红墨水上升 |
| B.图2中:观察到湿润的有色布条能退色,待尾气全部被碱吸收后,将稀硫酸滴入烧杯中,至溶液显酸性,可能看到有黄绿色气体生成。 |
| C.图3可用于制备乙酸乙酯 |
D.图4可以比较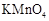 、 、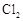 和S氧化性的相对强弱 和S氧化性的相对强弱 |
市场上经常见到的标记为Li-ion的电池。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为: Li+2Li0.35NiO2 2Li0.85NiO2,下列说法不正确的是( )
2Li0.85NiO2,下列说法不正确的是( )
| A.放电时,负极的电极反应式:Li-e-=Li+ |
| B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应 |
| C.该电池既能用酸溶液又能用碱溶液作电解质溶液。 |
| D.放电过程中Li+向正极移动 |
下列离子方程式的书写正确的是()
| A.氢氧化钡溶液与等物质的量的稀硫酸混合:Ba2++2OH-+2H++SO42-==BaSO4↓+2H2O |
| B.向澄清石灰水中通入足量的CO2:CO2+Ca2++2OH-=CaCO3↓+H2O |
| C.高锰酸钾酸性溶液吸收二氧化硫:SO2+MnO4-+4H+=SO42-+Mn2++2H2O |
| D.从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
常温下,下列各组离子在指定溶液中能大量共存的是()
| A.由水电离的c(H+)=10-4mol/L的溶液中:Fe2+、SO42—、K+、NO3— |
| B.由水电离的c(H+)=10-14mol/L的溶液中:Ca2+、Na+、HCO3—、NO3— |
| C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、SO42—、Cl— |
| D.c(Fe3+)=0.1mol/L的溶液中:Na+、K+、NO3—、SO32— |