实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________________(填仪器名称)。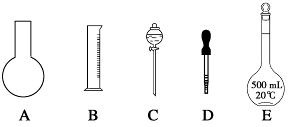
(2)下列操作中,容量瓶所不具备的功能有________(填序号)。
| A.配制一定体积准确浓度的标准溶液 |
| B.贮存溶液 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.准确稀释某一浓度的溶液 |
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol/L(填“大于”、“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是___________________________________________。
甲酸甲酯水解反应方程式为:HCOOCH3 + H2O  HCOOH + CH3OH – Q(Q>0)
HCOOH + CH3OH – Q(Q>0)
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表。甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
| 组分 |
物质的量/mol |
| HCOOCH3 |
1.00 |
| H2O |
1.99 |
| HCOOH |
0.01 |
| CH3OH |
0.52 |

(1)上述反应的平衡常数表达式为K=_______________________。
(2)计算15~20min范围内:甲酸甲酯的减少量为mol,甲酸甲酯的平均反应速率为mol/min;80~90min范围内甲酸甲酯的平均反应速率为___________ mol/min。
(3)依据以上数据,推断该反应在10min后反应速率迅速加快的原因:。
(4)其他条件不变,提高温度为T2,在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。各物质在不同温度下的溶解度见表。
  温度℃ 温度℃溶解度 溶质 g/100g水 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
| NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
| NH4HCO3 |
15.8 |
21.0 |
27.0 |
||||
| NaHCO3 |
8.2 |
9.6 |
11.1 |
12.7 |
14.4 |
16.4 |
|
| NH4Cl |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
60.2 |
实验步骤
Ⅰ、化盐与精制:①粗盐(含Ca2+、Mg2+、SO42-)溶解;②加入足量NaOH和Na2CO3溶液,煮沸;③过滤;④加入盐酸调pH至7。
Ⅱ、转化:①将精制后的食盐溶液温度控制在30~35℃之间;在不断搅拌下,加入研细的碳酸氢铵;保温,搅拌半小时;②静置, a、 b;③得到NaHCO3晶体。
Ⅲ、制纯碱:将得的NaHCO3放入蒸发皿中,在酒精灯上灼烧,冷却到室温,即得到纯碱。
完成下列填空:
(1)“化盐与精制”可除去的粗盐中的杂质离子是。
(2)“转化”的离子方程式是。
(3)“转化”过程中,温度控制在30~35℃之间的加热方式是;为什么温度控制在30~35℃之间?。
(4)a、b处的操作分别是、。
(5)实验室制得的纯碱含少量NaCl还可能含少量NaHCO3,为测定纯碱的纯度,用电子天平准确称取样品G克,将其放入锥形瓶中用适量蒸馏水溶解,滴加2滴酚酞,用c mol/L的标准盐酸滴定至溶液由浅红色变成无色且半分钟不变,滴定过程中无气体产生,所用盐酸的体积为V1 mL。此时发生的反应为:CO32- + H+ →HCO3-
①样品中碳酸钠质量百分含量的表达式是。
②向锥形瓶溶液中继续滴加2滴甲基橙,用同浓度的盐酸继续滴定至终点,所用盐酸的体积为V2mL。滴定终点时溶液颜色的变化是;根据实验数据,如何判断样品含有NaHCO3。
某实验小组设计了下列装置进行氨的催化氧化实验。
完成下列填空:
(1)常温下,氨水的浓度为1:1.5(28%的浓氨水和水的体积比)时实验现象明显,配制该浓度氨水的玻璃仪器有。
(2)本实验用的干燥剂是碱石灰和无水氯化钙。则甲处是____________;乙处是___________。
(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明反应是_____(填“吸”或“放”)热反应;化学方程式为。
(4)实验前,烧杯中盛有200mL 1.000 mol/L的 NaOH溶液,实验后测得烧杯中溶液的pH=13,且溶液质量比反应前增加了7.48g,则NaOH溶液吸收的NO和NO2的物质的量之比
是(设溶液的体积不变且忽略盐类的水解)。
(5)实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生白烟。其原因可用化学方程式表示为:、。
(6)已知NH3和N2常压下的沸点分别为:-33.5℃和-195.8℃,据此推测这两种物质中,能做制冷剂的是 (填分子式);能用来冷冻物质的是(填分子式)。
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,该晶体具有Na2CO3和H2O2的双重性质。利用图-2装置制备过碳酸钠,在冷水浴中充分反应后,按图-1流程可获得过碳酸钠产品。
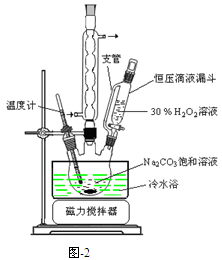
完成下列填空:
(1)恒压滴液漏斗中支管的作用是。
(2)制备过碳酸钠的关键是。
(3)不会使过碳酸钠失效的物质是_______(选填编号)。
a.Na2Sb.CH3COOH c.NaHCO3
过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数。
(4)完成实验步骤:
溶解 → 沉淀反应 → ________ → ________ → ________ → ________ 。
(5)写出沉淀反应的离子方程式________________________________________。
(6)需要直接测定的物理量有:________________________________(用字母表示并注明其含义)。产品中过碳酸钠质量分数的表达式为:________________。
某化学小组同学为了验证日常生活所用火柴头中的化学成分(含KClO3、MnO2、S等),设计了以下实验流程(见图-1):
试回答以下问题:
(1)燃着的火柴按图-2进行实验,若试管中能观察到的现象,则可证明火柴头中含有硫元素。图中针筒的作用是。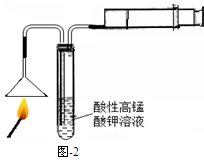
(2)为了证明火柴头中含有氯元素,后续的实验步骤是。
(3)有同学提出检验火柴头中KClO3的另一实验方案: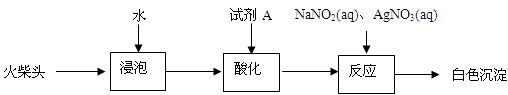
试剂A为,加入NaNO2的目的是。
(4)设计实验:简述验证滤渣D中含有MnO2的一个实验方案,并写出有关反应的化学方程式。。