(16分。每空格2分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出A、B、C三种元素电负性由大到小的顺序 。
(2)由A、B、C和氢四种元素组成的某种离子晶体,1mol该晶体含有配位键2mol,该晶体的化学式是 。
(3)F和Mn(锰)两元素的部分电离能数据列于下表:预测a b(填“大于”、“小于”、“等于”)
理由是
| 元素 |
Mn |
F |
|
| 电离能 (  ) ) |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
a |
b |
(4)AC2分子中 键和
键和 键数目比为 ;
键数目比为 ;
AC2分子中A原子的杂化方式是 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| |
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
| H2S |
187 |
202 |
2.6 |
| H2C2 |
272 |
423 |
以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因是:
①熔点、沸点差异的主要原因
②在水中的溶解度差异的主要原因
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。制三氯化铬的流程如下:
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净________________。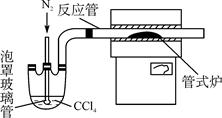
(2)已知CCl4沸点为76.8 ℃,为保证稳定的CCl4气流,适宜的加热方式是________。
(3)用右图装置制备CrCl3时,反应管中发生的主要反应为Cr2O3+3CCl4===2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用为①____________________________;
②____________________________。
(4)Cr对环境会造成严重的污染,废水中的Cr3+可用石灰乳进行沉降,写出沉降的离子方程式________________________
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)===CO(g)+3H2(g);ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g);ΔH=247.4 kJ·mol-1
2H2S(g)===2H2(g)+S2(g);ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与 H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为____________________________。
(2) H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是________________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:________________________。
(3) H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A.B表示的物质依次是________。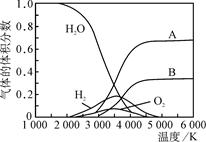
图1
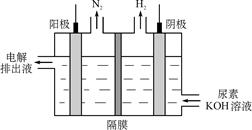
图2
(4)电解尿素[CO(NH2)2 ]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴.阳极均为惰性电极)。电解时,阳极的电极反应式为 。
(5) Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________________________。
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: 
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)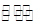 2SO3(g),该反应的平衡常数表达式为K=________;过量的SO2与NaOH溶液反应的化学方程式为____________________________。
2SO3(g),该反应的平衡常数表达式为K=________;过量的SO2与NaOH溶液反应的化学方程式为____________________________。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是______________.______________。
(3)通氯气氧化时,发生的主要反应的离子方程式为________________________;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为____________(写化学式)。
某同学用10mol• L-1 的浓盐酸配制250mL 1mol• L-1 的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸____________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有________________、___________。
(3)实验室中所用少量氯气用下列方法制取:4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O。
Cl2↑+MnCl2+2H2O。
试回答下列问题:
该反应中_____________是氧化剂,氧化产物是_______________。
若产生标准状况下的Cl2 2.24L,则被氧化的HCl__________mol。
铜在常温下能被稀HNO3溶解:3Cu+8HNO3(稀)="=" 3Cu(NO3)2+2NO↑+4H2O
⑴ 请将上述反应改写成离子方程式:_____________________。
⑵ 上述反应中氧化剂是,没有参加氧化还原反应的硝酸占总硝酸的比例_____。
(3)取1.92gCu与一定量浓HNO3恰好完全反应,生成气体颜色由红棕色逐渐变成无色,共得到标准状况下气体1.12L,则参加反应的硝酸为_____________mol。