某研究小组对铁生锈进行研究: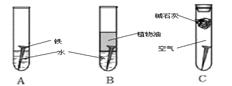
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是 (填字母);
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为: ;
(3)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是
A. 锡 B. 铜 C. 锌
(4)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下: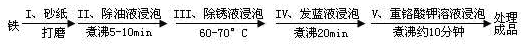
为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
(7分)Fe(OH)3胶体中常混有FeCl3和HCl。试回答:
(1)检验Fe(OH)3胶体中是否存在FeCl3的方法是。
(2)检验Fe(OH)3胶体中是否存在HCl的方法是。
(3)除去Fe(OH)3胶体中混有的FeCl3和HCl的方法是。
某学校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究。
甲同学:为制备消毒液,探究并制作了一种家用环保型消毒液(NaClO溶液)发生器,设计了如图所示的装置,用石墨作电极电解饱和氯化钠溶液。
请完成下列问题:若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源的a电极名称为极(填“正”、“负”、“阴”或“阳”);装置溶液中反应生成NaClO的离子方程式为:。
乙同学:从某超市中查询到某品牌消毒液包装说明的部分内容,摘录如下:
主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。
请完成以下实验探究过程:
I.阅读材料,根据学过的知识判断问题
(1)室温条件下,该消毒液(NaClO)的不显中性的原因是(用离子方程式表示)
_____________________。
(2)该消毒液还具有的化学性质是_________(填序号)。
A.强氧化性 B.强还原性 C.不稳定性 D.漂白性 E.弱酸性
(3)从该消毒液的保存要求分析,导致其失效的主要原因是(用化学方程式表示)
_。
II.确定要研究的问题
该消毒液对碳钢制品的腐蚀原理。
III.设计方案,实施探究
(1)用烧杯取少量样品,将一颗光亮的普通碳钢钉放入烧杯,浸泡一段时间。
预期的实验现象是_________________________________。
(2)为了进一步探究铁钉在该漂白剂(NaClO)溶液中的腐蚀原理,丁同学设计了如下图实验装置,写出碳(C)极上发生的电极反应式:。
某研究性学习小组用下图所示装置制取氯气并探究氯气的性质。请回答下列问题:
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的MnO2和NaCl,通过(填写仪器名称)向烧瓶中加入适量的浓硫酸。
(2)某同学查阅资料后发现浓硫酸与二氧化锰反应产生氧气。先需要你帮该同学设计一个实验,既要完成(3)、(4)的实验,又要探究有氧气产生的实验。仪器连接顺序为a→( )→( )→d→e→( )→( )→( )→( )→l,证明有氧气的操作是,写出浓硫酸与二氧化锰反应产生氧气的化学方程式
(3) 实验中可观察到③的锥形瓶里溶液的颜色变化
(4)取出④中的集气瓶进行氯气与铜的反应实验,应该进行的操作是后立刻放入充满氯气的集气瓶中。实验中有同学提出应该在集气瓶底先放少量的水或细沙,你认为是否一定要放;理由是。
(14分)已知A是一种含两种元素组成的液态有机溶剂,N带有磁性,B、F、L、O、P是中学化学常见单质, B、D、F、J都含有一种相同的元素且它们的相对分子质量关系是M(D)=2M(B)=2M(F),A和B反应前后气体体积(常温常压)保持不变,I是一种常用的氮肥,反应①②③均是化工生产中的重要反应。
⑴A的化学式___________。
⑵写出反应①的化学方程式_______________________________。
在工业上叫______________
⑶高温下反应⑤⑥互为可逆反应,写出反应⑥的化学方程式___________________
(4)写出在加热条件下单质F与单质L的化学反应方程式___________________________。
(5)请设计一个实验方案,完成反应④,并在答题卡指定位置绘出实验装置图。
实验室制取乙烯时,常因温度过高而发生副反应。完成下列问题:
(1)写出实验室制取乙烯的化学方程式:______________________。
(2)较高温度下,乙醇与浓H2SO4反应生成了CO2、SO2、H2O,写出并配平此副反应:________________,反应过程中,混合液颜色加深,变黄、变黑,证明___________________。
(3)请用下图中编号为①②③④的装置设计一个实验,以验证乙烯的性质和上述混合气体中含有CO2、SO2和水蒸气。用装置的编号表示装置的连接顺序(按产物气流从左到右):________→________→________→________。
(4)装置①中A瓶的现象是___________________,原因是______________________;B瓶的作用是______________________;确证乙烯存在的现象是______________________。
(5)装置③中加的固体药品是________,以验证混合气体中含有________;装置②中盛的溶液是________,以验证混合气体中的________。
(6)装置①在整套装置中所放位置的理由是_________________________________________。