氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化, CH4是sp3型杂化 |
| B.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| C.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| D.氨气分子是极性分子而甲烷是非极性分子。 |
硫酸钾和硫酸铝的混合溶液,已知其中Al3+的浓度为0.4 mol/L,硫酸根离子浓度为0.7 mol/L,则K+的物质的量浓度为
| A.0.1 mol/L | B.0.2 mol/L | C.0.3 mol/L | D.0.15 mol/L |
某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了。由此得出的以下结论中正确的是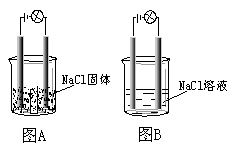
| A.NaCl是非电解质 |
| B.NaCl溶液是电解质 |
| C.NaCl在水溶液中电离出了可以自由移动的离子 |
| D.在NaCl溶液中,水电离出了大量的离子 |
下列关于分散系的说法,正确是
| A.稀硫酸、盐酸、空气和水等都是分散系 |
| B.一般可用丁达尔现象区分溶液和浊液 |
| C.按稳定性由弱到强的顺序排列的是溶液、胶体、浊液(以水为分散剂时) |
| D.按照分散质和分散剂的状态(气、液、固态),它们之间可以有9种组合方式 |
下列装置能达到对应实验目的的是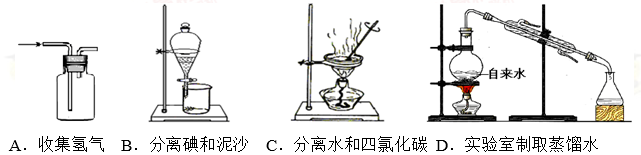
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.64g SO2含有氧原子数为NA |
| B.常温常压下,14g N2含有分子数为0.5NA |
| C.标准状况下,22.4L H2O的分子数为NA |
| D.物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA |