下列说法不正确的是
| A.元素的第一电离能(I1)是元素的单质失去最外层1个电子所需要吸收的能量,同周期从左到右元素的I1逐渐增大。 |
| B.元素的电负性是衡量元素在化合物中吸引电子能力大小的一种标度,同主族从上到下元素的电负性逐渐减小。 |
| C.含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中不一定含有阴离子。 |
| D.原子晶体中一定含有共价键;离子晶体中一定含有离子键,可能含有共价键;分子晶体中一定存在分子间作用力。 |
NA代表阿伏加德罗常数,下列说法错误的是
| A.标准状况下,22.4 L NO和22.4 L O2的混合,混合气体中含有的氧原子数为3NA |
| B.0.012 kg 13C中,含中子数为7NA |
| C.25 ℃时,1 L pH=13的氢氧化钡溶液中含有0.1NA个氢氧根离子 |
D.在反应3SiO2+6C+2N2  Si3N4+6CO,生成1 mol Si3N4时共转移12 NA电子 Si3N4+6CO,生成1 mol Si3N4时共转移12 NA电子 |
下列说法错误的是
| A.1个 C3H8分子中的共价键总数为10 |
| B.除去苯中含有的少量溴可以加入NaOH溶液,然后蒸馏出苯 |
| C.可用溴的四氯化碳溶液除去丙烷中的丙烯 |
| D.某聚乙烯单链分子的相对分子质量为519766,则该聚乙烯单链分子的聚合度为19991 |
在20 mL 0.1mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是
| A.溶液��性时,回滴加入适量的NaOH,溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| B.C点时其pH=5.6,溶质恰好为等物质的量CH3COONa和CH3COOH,则溶液中微粒浓度关系为:c(Na+)>c(CH3COO-) |
| C.在B点,a>20,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| D.在D点:c(CH3COOH)=c(OH-)-c(H+) |
乙醇与重铬酸根离子在酸性溶液中能发生如下反应:C2H5OH+ +H+—→CO2↑+Cr3++H2O,当这个方程式配平后,H+的化学计量数为
+H+—→CO2↑+Cr3++H2O,当这个方程式配平后,H+的化学计量数为
| A.10 |
| B.12 |
| C.14 |
| D.16 |
下列说法错误的是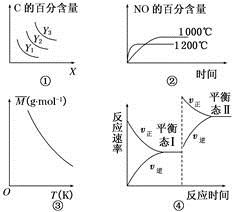
A.对于A(s)+2B(g)  3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1
3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1
B.已知可逆反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响
C.已知反应2A(g)  B(?)+2C(?)-Q(Q>0),满足如图③所示的关系,则B、C可能均为气体
B(?)+2C(?)-Q(Q>0),满足如图③所示的关系,则B、C可能均为气体
D.图④是恒温下某化学反应的反应速率随反应时间变化的示意图,则该反应的正反应是一个气体体积增大的反应