下图是几种有机物的转换关系,请按要求填空: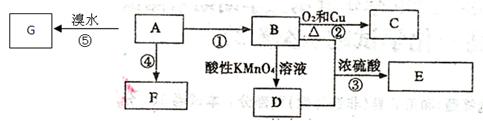
已知:A是来自石油的重要有机化工原料,对水果有催熟作用;75%的B可用于医用消毒;E是具有果香味的有机物;F是一种高聚物,可制成多种包装材料。
(1)A的分子式为 ,A和酸性高锰酸钾溶液作用的现象是: 。
(2)C的名称 ,F的结构简式为 。
(3)D分子中的官能团名称是 ,请设计一种实验来验证D物质存在该官能团的方法是
。
(4)请写出反应⑤的方程式: 。
(5)请填写反应类型:A生成F ;
(6)下列关于A和F的叙述正确的是 。
| A.A常温下是气体,为纯净物;F常温下是固体,为混合物 |
| B.A与F的化学性质完全相同 |
| C.取等质量的A和F完全燃烧后,生成的CO2和H2O的质量分别相等 |
| D.取等物质的量的A和F完全燃烧后,生成的CO2和H2O的物质的量分别相等 |
(12分,每空2分) 现有A、B、C、D、E、F六种常见化合物,已知它们:阳离子分别有K+、Ag+、Na+、Ba2+、Fe2+、Al3+;阴离子分别有Cl-、OH-、AlO、 NO、SO、CO。将它们分别配成0.1 mol/L的溶液进行如下实验:
NO、SO、CO。将它们分别配成0.1 mol/L的溶液进行如下实验:
①测得溶液A、C、E均呈碱性,且碱性:A>E>C,E的焰色呈浅紫色(透过蓝色钴玻璃观察);
②向B溶液中滴加稀氨水至过量,先生成沉淀,后沉淀全部溶解;
③向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成;
④向D溶液中滴 加Ba(NO3)2溶液无明
加Ba(NO3)2溶液无明 显现象。
显现象。
(1)写出A、D、E、F的化学式:
A__________________;
D__________________;
E__________________;
F__________________。
(2)用离子方程式解释C溶液的碱性:________________________________________。
(3)写出实验③中反应的离子方程式:_________________________________________。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
(1)写出该反应的化学方程式 ,其中氧化剂是, 8.4g铁粉参加反应,转移电子mol。
,其中氧化剂是, 8.4g铁粉参加反应,转移电子mol。
(2)干燥管内使用的干燥剂可以是下列物质中的(填序号)。
①浓硫酸②碳酸钠③碱石灰④过氧化钠
(3)硬质玻璃管中石棉绒的作用是,圆底烧瓶中盛装水和,加入后者的作用是。
(4)实验开始时应先点燃,实验结束时应先熄灭,检验生成的气体 的方法是。
的方法是。
下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。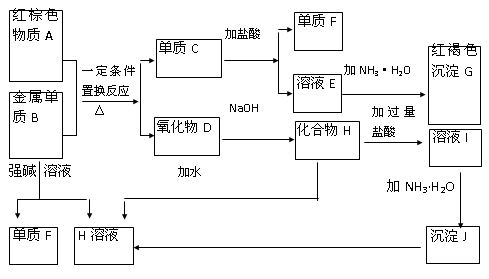
(1)单质B的化学式是,单质F的化学式是________ ,写出物质A的一种用途。
(2)写出单质B与强碱溶液反 应的离子方程式,
应的离子方程式,
写出由沉淀J生成 H溶液的离子方程式,
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式,
白色沉淀L会迅速变为色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式。
(4)溶液I中所含金属离子是_____________________。
丙烯是石油化工的重要原料,一定条件下可发生下列转化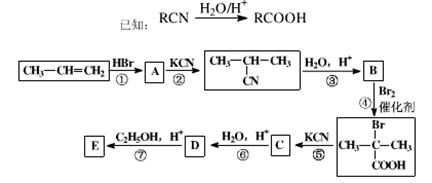
(1)A的结构简式为____________
(2)D与足量乙醇反应生成E的化学方程式为_____________________________________ ________
________
(3) 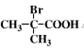 与足量NaOH水溶液发生反应的化学方程式为_________
与足量NaOH水溶液发生反应的化学方程式为_________ ________
________
(4)B有多种同分异构体,写出其中既能发生银镜反应又能发生酯化反应的2种同分异构体的结构简式_______________________、_________________________
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。A. KMnO4 B. H2O2 C. Cl2水D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。A. NaOHB. NH3·H2OC. CuOD. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常 温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10
温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10 -
- 5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。