18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫 酸100 ml,实验操作如下:
(1)计算并用量筒量取 ml的18.0 mol·L-1的浓硫酸;
(2)将 沿烧杯内壁慢慢注入盛有少量 的烧杯中;
(3)将已冷却至室温的硫酸溶液沿玻璃棒注入 ___________;
(4)用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
(5)继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处,改用胶头滴管逐滴加蒸馏水,至液面与刻度线相切
(6)盖好容量瓶塞,反复颠倒摇匀,将配好的稀硫酸倒入试剂瓶中,贴好标签保存。
试分析下列操作对实验结果的影响(偏高、偏低或无影响)
①没有洗涤烧杯和玻璃棒
②定容时俯视读数
③容量瓶使用前有少许水残留
(10分)实验室常用的几种气体发生装置如图A、B、C所示: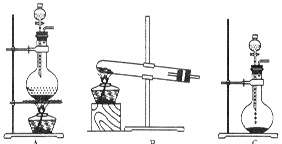

AB CD
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是(填序号,下同。)①密度 ②颜色 ③溶解性 ④热稳定性
下图是某学生设计收集气体的几种装置,其中不可行的是。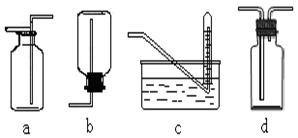
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的_______,
①CO2 ② NO ③ Cl2 ④H2
其中在D装置中连接小烧杯的目的是________________________。
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程: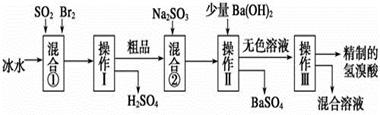
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为______________________________________。
(2)混合①中使用冰水的目的是_________________________________。
(3)操作Ⅱ和Ⅲ的名称分别是________、__________。操作Ⅲ一般适用于分离_______混合物(选填编号)。
a.固体和液体 b.固体和固体
c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是____________________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)常带有淡淡的黄色。于是甲、乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为____________,若假设成立可观察到的现象为____________________________。乙同学假设工业氢溴酸呈淡黄色是因为_____________________________,其用于证明该假设所用的试剂为______________。
某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
| 检测次数 |
溶液中检测出的物质 |
| 第一次 |
KCl、K2SO4、Na2CO3、NaCl |
| 第二次 |
KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 |
Na2SO4、KCl、K2CO3、NaCl |
(1)三次检测结果中第__________次检测结果不正确。
(2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子:
第一步:向溶液中滴加过量的 溶液(填化学式),其目的是检验CO32-
并将其除去;
第二步:加入溶液(填化学式),其目的是;
第三步:过滤,再向滤液中加入_____________溶液(填化学式),其目的是;
实验室欲用质量分数为98%、密度为1.84g/cm3的浓硫酸,配制200mL 1.0 mol/L硫酸溶液:
(2)该实验室只备有①100 mL、②150 mL、③250 mL、④500 mL四种规格容量瓶,你认为应选用的容量瓶是(填写编号)。
(2)需要量取mL浓硫酸(保留一位小数)。
(3)该学生配制的操作过程如下:
①用量筒准确量取一定体积的浓硫酸,倒入适量小烧杯中;
②将适量蒸馏水慢慢倒入上述烧杯中并不断搅拌,冷却至室温;
③将烧杯中的溶液沿玻璃棒倒入选定的容量瓶中;
④用少量蒸馏水洗涮小烧杯1~2次,将洗涤液沿玻璃棒均转入容量瓶中;
⑤将蒸馏水沿玻璃棒倒入容量瓶中,至液面距离刻度线1~2cm为止;
⑥改用胶头滴管滴加蒸馏水,至凹液面最低处与刻度线相切;
⑦盖好瓶塞,上下翻转摇匀。
上述操作中你认为不正确或不合理的是(填序号)。
若用胶头滴管滴入水时,不小心滴过了刻度线,你认为应该采取的处理方法是:。
某同学配制1000mL 1.00mol/L NaCl溶液的步骤如下:
①用托盘天平称取58.5g NaCl固体并全部移入烧杯中;
②在上述烧杯中加入适量的蒸馏水,搅拌至NaCl固体全部溶解,冷却至室温;
③将烧杯中的溶液倾倒至容量瓶中;
④将蒸馏水注入容量瓶至刻度线下1cm~2cm;
⑤用胶头滴管滴加蒸馏水至液面与刻度线相切;
⑥盖好瓶塞,反复上下颠倒摇匀;
⑦静置后因液面低于刻度线再用胶头滴管滴加蒸馏水至液面与刻度线相切。
你认为上述步骤中不合理或不正确的是(填写序号)