反应A+3B===2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15mol/(L·s) ②v(B)=0.6 mol/(L·s) ③v(C)=0.4 mol/(L·s)④v(D)=0.45 mol/(L·s)其中,反应进行得最快的是
A.① B.② C.③ D.④
工业制取乙醇常用乙烯水合法:CH2 = CH2 + H2O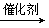 CH3CH2OH。以下相关叙述错误的是
CH3CH2OH。以下相关叙述错误的是
| A.该反应属加成反应 |
| B.乙烯可以通过石油裂解获得 |
| C.乙醇官能团为羟基 |
| D.乙醇、乙醛和乙酸互为同系物 |
常温下,将一元酸和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是
A.实验①反应后的溶液中: c(K+) > c(A-) > c(OH-) > c(H+)
B.实验①反应后的溶液中: c(OH-) = c(H+) + c(HA)
C.实验②反应后的溶液中: c(A-) + c(HA) > 0.2 mol·L-1
D.实验②反应后的溶液中: c(K+) = c(A-) > c(OH-) = c(H+)
下列叙述中正确的是
| A.图①中正极附近溶液pH降低 |
| B.图②正极反应是2MnO2(s)+H2O(l)+2e-= Mn2O3(s)+2OH-(aq) |
| C.图①中电子由流向石墨,盐桥中的Cl—移向FeSO4溶液 |
| D.Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
某课外实验小组设计的下列实验合理的是
下列解释实验现象的反应方程式正确的是
| A.在CH3COONa溶液中,滴加酚酞变红:CH3COO- + H2O === CH3COOH + OH- |
| B.在H2O2溶液中,滴加FeCl3溶液产生气泡:2H2O2 + 2Cl- === 2H2O + O2↑+ Cl2↑ |
| C.将相互接触的铜片和锌片置于稀硫酸中,铜片表面有气泡产生:Cu + 2H+ === Cu2+ + H2↑ |
D.向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑色:Cu(OH)2(s) + S2- (aq)  CuS(s) + 2OH- (aq) CuS(s) + 2OH- (aq) |