设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A常温常压下,18g H2O含有的原子总数为3NA.
B.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
C.标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA
D.1.0L的0.1 mol·L-1Na2S溶液中含有的S2-离子数为0.1NA
已知25℃时,0.2mol/L某酸HA 与0.1mol/LNaOH等体积混合,溶液pH>7;含等物质的量的盐NaB和酸HB混合液pH<7。该温度下,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是()
A.c(Na+)>c(OH-)>c(HB)>c(HA) B.c(Na+)>c(OH-)>c(A-)>c(B-)
C.c(Na+)>c(OH-)>c(HA)>c(HB) D.c(OH-)>c(Na+)>c(B-)>c(A-)
设NA为阿伏加德罗常数的数值,下列说法中正确的是()
| A.标准状况下,1L水中含有的H+数目为10-7 NA |
| B.足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数为2NA |
| C.1mol硫酸钾中阴离子所带电荷数为NA |
| D.14g分子式为CnH2n的(n≥2)烯烃中含有的C=C的数目一定为NA/n |
.在实验室做用锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果
| 序号 |
锌的质量(g) |
锌的形状 |
温度(℃) |
完全溶 解于酸的时间(s) 解于酸的时间(s) |
| A |
2 |
薄片 |
5 |
400 |
| B |
2 |
薄片 |
15 |
200 |
| C |
2 |
薄片 |
25 |
100 |
| D |
2 |
薄片 |
30 |
t1 |
| E |
2 |
薄片[ |
35 |
50 |
| F |
2 |
颗粒 |
15 |
t2 |
| G |
2 |
粉末 |
15 |
t3 |
①t1=75②t2>200>t3③单位时间内消耗的锌的质量m(C)>m(B)>m(G)
则下列说法正确的是()
A.①③ B.①②C.只有② D.全部正确
A、B、C、D四种短周期元素,其核电荷数依次增大,已知元素A和D可形成两种常温下均为液体的化合物,B原子最外层电子数是最内层电子数的两倍。则下列由四种元素形成的化合物的化学式或结构式不正确的是
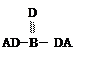 |
|||
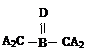 |
A.B2A6CD2 B. C.D.B2A5D2C
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如右图所示的原电池(盐桥起到导电作用)。下列判断不正确的是
2Fe2++I2设计成如右图所示的原电池(盐桥起到导电作用)。下列判断不正确的是
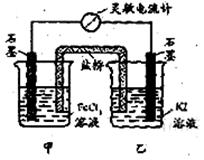

A.反应开始时,乙中石墨电极上发生氧化反应 |
B.反应开始时,甲中石墨电极作负极 |
C.电流计读数为零时,反应达到化学平衡状态 |
D.电流计读数为零后,在甲中溶入FeCl2,电流表可能会再次产生偏转 |