已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×l0–5 |
4.9×l0–10 |
K1=4.3×l0–7 K2=5.6×l0–11 |
则下列有关说法正确的是( )
A、等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B、将a mol·L—1 HCN溶液与a mol·L—1 NaOH溶液等体积混合,混合液中:c(OH–)>c(H+),c(Na+)>c(CN–)
C、冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
D、NaHCO3和Na2CO3混合液中,一定有c(Na+)+ c(H+)=c(OH–)+ c(HCO3–) +c(CO32–)
下列事实不能用电化学理论解释的是( )
| A.轮船水线以下的船壳上镶嵌有一定量的锌块 |
| B.镀锌的铁制品比镀锡的铁制品耐用 |
| C.铁在潮湿的空气中容易腐蚀 |
| D.常温下铝跟稀硫酸快速反应,跟浓硫酸几乎不反应 |
把0.6 mol气体X和0.4mol气体Y混合于2L容器中,使其发生如下反应:3X (g)+ Y(g) 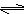 nZ (g) + 2W (g),5min末生成0.2 mol W,若测得以Z浓度变化表示的平均反应速率为0.01 mol·(L·min)-1,则n的值为()
nZ (g) + 2W (g),5min末生成0.2 mol W,若测得以Z浓度变化表示的平均反应速率为0.01 mol·(L·min)-1,则n的值为()
| A.1 | B.2 | C.3 | D.4 |
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为:
C 2—+2e—→C,B—2e—→B2+则A、B、C、D金属性由强到弱的顺序为()
A.A>B>C>D B.A>B>D>CC.D>A>B>C D.D>C>A>B
在如图所示的装置中,a的金属活泼性在氢前,b为碳棒,关于此装置的各种叙述不正确的是( )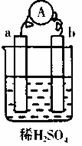
| A.a是正极,b是负极 |
| B.碳棒上有气体放出 |
| C.a极上发生了氧化反应 |
| D.溶液中H+从a极移动到b极 |
下列叙述正确的是( )
| A.物质燃烧不一定是放热反应 |
| B.放热反应不需要从外界吸收任何能量就能发生 |
| C.在一个确定的化学反应中,反应物总能量总是高于生成物总能量 |
| D.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关 |