如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是( )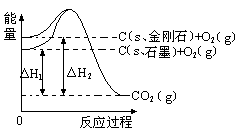
| A.C(s、石墨)==C(s、金刚石)△H=" +1.9" kJ•mol-1 |
| B.石墨和金刚石的转化是物理变化 |
| C.金刚石比石墨稳定 |
| D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
分别将下列物质:①FeCl3②CaO③NaCl④Ca(HCO3)2⑤Na2SO3⑥K2SO4投入水中,在蒸发皿中对其溶液加热蒸干,能得到原物质的是
| A.②③ | B.③⑥ | C.①④ | D.⑤⑥ |
下列表示水解的离子方程式正确的是
A.CH3COO— + H2O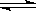 CH3COOH + OH— CH3COOH + OH— |
B.NH4+ + H2O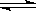 NH4OH + H+ NH4OH + H+ |
C.S2— + 2H2O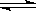 H2S+2OH— H2S+2OH— |
D.HCO3— + H2O 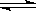 H3O++CO32— H3O++CO32— |
某温度下在密闭溶器中发生反应:2M(g)+N(g) 2E(g);若开始时只充入2mol E(g),达到平衡时,混合气体的压强比起始增大了20%;若开始时只充入2mol M和1mol N的混合气体达到平衡时M的转化率为
2E(g);若开始时只充入2mol E(g),达到平衡时,混合气体的压强比起始增大了20%;若开始时只充入2mol M和1mol N的混合气体达到平衡时M的转化率为
| A.80% | B.60% | C.40% | D.20% |
在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生反应:2SO2(g)+O2(g) 2SO3(g);ΔH<0。2min后,反应达到平衡,生成SO3为1.4 mol。则下列分析正确的是
2SO3(g);ΔH<0。2min后,反应达到平衡,生成SO3为1.4 mol。则下列分析正确的是
| A.在该条件下,反应前后的压强之比为6:5.3 |
| B.开始到达平衡:v(SO3)="0.35" mol/(L·min) |
| C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol |
| D.平衡时混合气体的平均摩尔质量减小 |
用CO合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是
CH3OH(g);ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是
| A.温度:T1>T2>T3 |
| B.正反应速率:v(a)>v(c) v(b)>v(d) |
| C.平衡常数:K(a)>K(c) K(b)=K(d) |
| D.平均摩尔质量:M(a)<M(c) M(b)>M(d) |