已知在25℃,101kPa下,1g 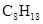 (辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
A.   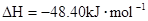 |
B.  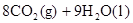 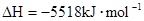 |
C.  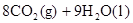 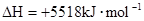 |
D.  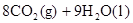 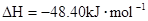 |
向等量的NaOH溶液中分别通入CO2气体。因CO2的通入量不同,得到组分不同的溶液M。若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)关系如下,(注:①假设CO2全部逸出;②C图中oa=ab)。其中M中只有1种溶质的是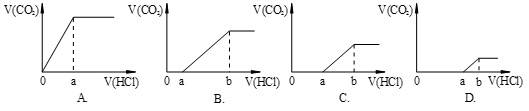
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A→HA- +H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减少 |
对表中有关离子方程式书写、评价合理的是
| 选项 |
化学反应及其离子方程式 |
评价 |
| A |
Fe3O4与过量稀硝酸反应:Fe3O4+8H+→2Fe3++Fe2++4H2O |
正确 |
| B |
在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液: 2Fe3++ 3SO42-+ 3Ba2++6OH-→3BaSO4↓+ 2Fe(OH)3↓ |
正确 |
| C |
在稀氨水中通入过量CO2:NH3·H2O+CO2→NH4++HCO3- |
正确 |
| D |
FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br—+2Cl2→2Fe3++4Cl—+Br2 |
错误,Fe2+与Br—的化学计量数之比应为1:2 |
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如下图所示。下列说法中,正确的是
| A.两溶液稀释前的浓度相同 |
| B.a、b、c三点溶液的pH由大到小顺序为a>b>c |
| C.a点的KW值比b点的KW值大 |
| D.a点水电离的c(H+)大于c点水电离的c(H+) |
铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2 2PbO+2SO2;③制粗铅:PbO+C
2PbO+2SO2;③制粗铅:PbO+C Pb+CO↑;PbO+CO
Pb+CO↑;PbO+CO Pb+CO2。下列说法正确的是
Pb+CO2。下列说法正确的是
| A.浮选法富集方铅矿的过程属于化学变化 |
| B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO |
| C.整个冶炼过程中,制取1 mol Pb共转移2 mol电子 |
| D.将1 mol PbS完全冶炼成Pb理论上至少需要6 g碳 |