某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g,把80g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的等杂质不溶于水也不与稀盐酸反应)。Ca CO3十2HCl= CaC12十H2O十C02↑
请计算:
| 序号 |
加入稀盐酸的质量/g |
剩余固体的质量/g |
| 第1次 |
20 |
12 |
| 第2次 |
20 |
8 |
| 第3次 |
20 |
4.8 |
| 第4次 |
20 |
n |
(1)上表中n的数值为___________。(2 分)
(2)石灰石中碳酸钙的质量分数为 。(写出计算过程)。
(3)反应前盐酸的质量分数?
(1)CO(NH2)2的相对分子质量。
(2)H2SO4中各种元素的质量比为。
(3)200t含有氧化铁80%的铁矿石中含有多少吨铁元素?
实验室欲配制100g溶质质量分数为10%的氯化钠溶液。配制步骤为:
(1)需氯化钠固体和水的质量各多少克?
(2)量取水最好选择_______的量筒(填序号①10mL②50mL③100mL)(水的密度为1g/cm3)。
(3)将氯化钠固体溶于水,用搅拌,使氯化钠全部溶解,冷却至室温,装瓶储存。
(4)若将100g溶质质量分数为10%的氯化钠溶液稀释成5%的溶液,需要加水的质量多少g?
低钠盐适合患有高血压、肾病、心脏病的患者服用,苹果酸钠盐(C4H5O5Na)是低钠盐的一种。请回答:
(1)苹果酸钠盐的相对分子质量是。
(2)苹果酸钠盐中各元素的质量比为C:H:O:Na=。(写出计算过程)
(3)若某病人每天食用5.85g苹果酸钠盐,摄入钠元素多少克?(计算结果保留一位小数)
2011年是国际化学年(IYC2011),其宗旨是“增进公众对化学重要性的认识,鼓励青年人热爱化学,学习和研究化学”。某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁(K1,K2是活塞):
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物。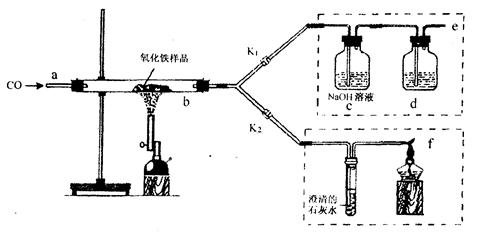
①这是关于气体的实验,实验前必须对装置进行装置的气密性检查
②CO还原Fe2O3的化学方程式为 ;
③在f处点燃气体的目的是 。
(2)关闭K2,开启K1,可以将e口出来的气体再从a通入装置而循环使用。
①d瓶中应装(填序号)。
| A.澄清石灰水 | B.水 | C.石蕊溶液 | D.浓硫酸 |
②该实验这样改进的主要优点是 。
(3)小刚用一种不纯的氧化铁粉末样品(杂质为铁粉),通过该实验测定样品中氧化铁的质量分数。小刚称取10g样品,利用上图所示装置进行实验,相关实验数据见下表:(玻璃管内的物质完全反应)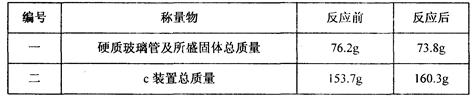
①由上表数据可分析出,反应后硬质玻璃管及所盛固体总质量减少的是的质量。
②请依据c装置总质量变化的数据,计算出样品中氧化铁的质量分数(写出计算过程)。
(8分)(1)元素M的某化合物的化学式为MCO3,它的相对分子质量为197。推算M元素的相对原子质量为。
(2)某地区部分氮肥的销售价格如下:碳铵(NH4HCO3)480元/吨,尿素【CO(NH2)2】2400元/吨。某农民用1000元钱去购买氮肥,为了使所购化肥得到的氮最多,他应选购哪种氮肥(填写序号)
A.尿素 B.碳铵
(3)乳酸亚铁片可用于治疗缺铁性贫血。如图为乳酸亚铁片说明书上的部分文字。请仔细阅
读后同答以下问题:
①碳、铁两种元素的质量比为。
②在乳酸亚铁分子中氢原子与氧原子的个数比为。
③在乳酸亚铁中,氢元素的质量分数为。
④144g乳酸亚铁中铁元素的质量为g。