氢氧化钠和氢氧化钙是化学实验室中常用的试剂。
(1)氢氧化钠固体曝露在空气中,容易吸收水分而使表面覆盖一层溶液,这一现象又叫____________;它还能 ,这一变化的化学方程式可表示为 。所以氢氧化钠固体必须密封保存。
(2)实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,其原因是在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,产物使瓶口与瓶塞粘合在一起,反应的化学方程式为:SiO2 + 2NaOH ="=" X + H2O,试推断X的化学式为 。
(3)生石灰的主要成分为 (填化学式)。在食品包装中,常用生石灰作干燥剂,其干燥原理是 (用化学方程式表示);其生成物可以改良硫酸型土壤,写出化学方程式_________________________________。
下图是实验室制取气体的装置图(固定装置省略),请回答下列问题:
(1)仪器名称:a,b。
(2)B图的装置可用来制取一种具有助燃性的气体,写出制取该气体的化学方程式:,该装置操作上的优点是。
D装置操作上的优点是。
(3)写出实验室用高锰酸钾制取氧气的化学方程式,若用E收集一瓶干燥的氧气,其中Ⅰ瓶中盛放的试剂是(填名称),并将图E补充完整。
(4)实验室用锌粒与稀硫酸反应制取氢气,发生装置如图所示。打开止水夹,若发现稀硫酸未能与有孔塑料板上锌粒接触,但此时已无稀硫酸可加,则下列溶液中,最适宜从长颈漏斗中添加的是_________(填字母)。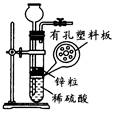
| A.氢氧化钠溶液 | B.碳酸钠溶液 |
| C.硫酸钠溶液 | D.澄清石灰水 |
FeSO4•7H2O是一种重要的食品和饲料添加剂。某工业废渣的主要成份是铁,同时还有
少量铁锈(Fe2O3),实验室用此废渣制备FeSO4•7H2O的流程如下:
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有另外2个反应:其中为反应器提供70℃-80℃所需热量的反应的化学方程式为:,属于复分解反应的另一反应化学方程式为 ;
(2)滤液M中肯定含有的溶质的化学式是 ;
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和;玻璃棒的作用是。
下表是元素周期表的一部分:
| 族 周期 |
IA |
0 |
||||||
| 一 |
1 H 1.008 |
ⅡA |
ⅢA |
ⅣA |
V A |
ⅥA |
ⅦA |
2 He 4.003 |
| 二 |
3 Li 6.941 |
4 Be 9.012 |
5 B 10.8l |
6 C 12.01 |
7 N 14.0l |
8 O 16.00 |
9 F 19.00 |
10 Ne 20.18 |
| 三 |
11 Na 22.99 |
12 Mg 24.31 |
13 Al 26.98 |
14 Si 28.09 |
15 P 30.97 |
16 S 32.06 |
17 Cl 35.45 |
18 Ar 39.95 |
(1)10号元素的元素名称为,F元素的相对原子质量为。
(2)X3+的结构示意图如图所示,该元素位于周期表中第周期,第族。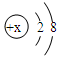
(3)写出原子序数1、6、8、11四种元素组成的化合物的化学式。
化学与我们息息相关,请用所学化学知识完成下列问题:
(1)餐具上的油污可用洗洁精洗掉,这是利用洗洁精的(填“溶解”或“乳化”作用。)
(2)我们穿的衣服通常是由纤维织成的,纤维又分为天然纤维和合成纤维,请你写出一种天然纤维的名称。
(3)许多人都喜欢吃牛肉,牛肉中富含的基本营养素是。
(4)炒菜时,有时燃气灶会产生黑烟,是因为燃料。
硝酸钾与氯化钾的溶解度曲线如图所示,回答下列问题: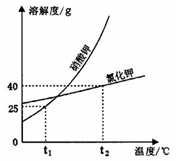
(1)t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是的溶液。
(2)t2℃时,将50g水加入盛有25g氯化钾的烧杯中,充分溶解后,得到氯化钾溶液的质量是g。保持温度不变,往该烧杯中再加入5g水,充分搅拌后,氯化钾溶液的溶质的质量分数(填“变大”、“不变”或“变小”)。
(3)当硝酸钾中混有少量氯化钾时,可用方法提纯硝酸钾。