在水溶液中呈橙红色的Cr2O72-与呈黄色的CrO42-有下列平衡关系:Cr2O72-+H2O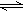 2CrO42-+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
2CrO42-+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
(1)取少许上述溶液加入NaOH溶液,溶液变_________色,因为___ ________。
⑵向⑴中再加入过量稀H2SO4,则溶液呈__ __色,因为__________ _________。
⑶取少许原溶液,向其中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡_____ ____,溶液颜色将_____ ____。
增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、酒类等行业。DBP是增塑剂的一种,可由下列路线合成。
已知以下信息:
①R1CHO+R2CH2CHO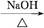
 +H2O
+H2O
②

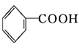
(—R1、—R2表示氢原子或烃基)
(1)A的结构简式为 ,D→E的反应类型为 。
(2)B的名称是 ,D中含有的官能团名称是 。
(3)由B和E合成DBP的化学方程式为 。
(4)写出同时符合下列条件的B的所有同分异构体结构简式 。
①能与NaHCO3溶液反应生成CO2 ②能发生银镜反应 ③能使FeCl3溶液发生显色反应 ④苯环上含碳基团处于对位
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: 。
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
| 共价键 |
C—C |
C—N |
C—S |
| 键能/(kJ·mol-1) |
347 |
305 |
259 |
(2)C 、—CH3(甲基)、C
、—CH3(甲基)、C 都是重要的有机反应中间体,有关它们的说法中正确的是( )
都是重要的有机反应中间体,有关它们的说法中正确的是( )
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.C 与NH3、H3O+互为等电子体,几何构型均为三角锥形
与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.C 中的碳原子采取sp2杂化,所有原子均共面
中的碳原子采取sp2杂化,所有原子均共面
E.两个—CH3(甲基)或一个C 和一个C
和一个C 结合均可得到CH3CH3
结合均可得到CH3CH3
(3)金属阳离子含未成对电子越多,则磁性越强,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(4)某配合物的分子结构如下图所示,其分子内不含有 (填序号)。
A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键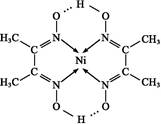
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为 。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为 (填元素符号),其原因为 。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为 ;1 mol B2A4分子中含 mol σ键。
(4)已知D、E能形成晶胞如下图所示的两种化合物,化合物的化学式,甲为 ,乙为 ;高温时,甲易转化为乙的原因为 。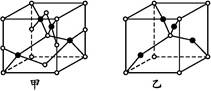
(1)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌元素在周期表中的位置: 周期, 族, 区。
②NH3分子中氮原子的杂化轨道类型为 ,基态氮原子的核外电子排布式是 。
③如图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C—C的键长为154.45 pm,C60中C—C键长为140~145 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。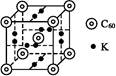
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如右图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60。C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
太阳能电池的发展已经进入了第三代。第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。完成下列填空:
(1)亚铜离子(Cu+)基态时的电子排布式为 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示),用原子结构观点加以解释 。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成加合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为 ,B与N之间形成 键。
(4)单晶硅的结构与金刚石相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得上图所示的金刚砂(SiC)结构;在SiC中,每个C原子周围最近的C原子数目为 。