在常温下20L密闭容器中通入a mol H2、b mol O2(a≤4,b≤4,a、b均为正整数),点燃后充分反应恢复至原温度时,容器内气体(水蒸气忽略不计)密度最大值可能是A
| A.5.6 g·L-1 | B.9.6 g·L-1 | C.11.2g·L-1 | D.56 g·L-1 |
能正确表示下列反应的离子方程式为()
| A. |
硫化亚铁溶于稀硝酸中:
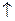
|
| B. | 溶于过量的 溶液中: |
| C. | 少量 通入苯酚钠溶液中: |
| D. |
大理石溶于醋酸中:
+
=
+
+
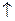 + +
|
铁镍蓄电池又称爱迪生电池,放电时的总反应为: 下列有关该电池的说法不正确的是()
| A. | 电池的电解液为碱性溶液,正极为 、负极为 |
| B. | 电池放电时,负极反应为 |
| C. | 电池充电过程中,阴极附近溶液的 降低 |
| D. | 电池充电时,阳极反应为 |
下列反应中,属于取代反应的是
①
②
③
④
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
分子式为 的同分异构体共有(不考虑立体异构)()
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
下列叙述正确的是
| A. | 1.00 中含有6.02×10 23个 分子 |
| B. | 1.00 中,所有 的最外层电子总数为8×6.02×10 23 |
| C. | 欲配置1.00 ,1.00 . 的 溶液,可将58.5 溶于1.00 水中 |
| D. | 电解58.5 熔融的 ,能产生22.4 氯气(标准状况)、23.0 金属钠 |