(13分) 下表为元素周期表的一部分,其中编号代表对应的元素。
请回答下列问题:
(1)写出元素⑦的基态原子排布式 ,元素⑧位于 区。
⑤元素原子的价层电子的轨道表示式为 ,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为 和 。
(3)元素④和⑥的第一电离能大小顺序是 > (用元素符号表示)。请写出由④和⑤两种元素形成的与N3-互为等电子体的离子的化学式 ,其VSEPR构型为 。
(4)在测定①和⑥形成的化合物的相对分子质量时,实验测得值一般高于理论值,其主要原因是 。
(5)④和⑧形成某种化合物的晶胞结构如右图所示(每个球均表示1个原子,其中④显-3价),则其化学式为 。
⑧的常见离子和④的最简单氢化物形成的配离子的名称为 ,
其水溶液颜色为 。
A、B、C、D是原子序数依次增大的同一短同期元素,A、B是金属元素,C、D是非金属元素。
(1)A、B各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为____________________。
(2)A与C 可形成化合物A2C,该化合物的电子式为______________。
(3)C的低价氧化物通入D单质的水溶液中,发生反应的化学方程式为_______________。
(4)A、B、C、D四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):
_____>_____>______>______。
(5)四种元素中金属性最强的(填元素符号)______;非金属性最强的__________
下列各物质中,互为同位素的是________,互为同素异形体的是________,互为同系物的是________,互为同分异构体的是__________,属于同一种物质的是________。
①金刚石与石墨
②12C与14C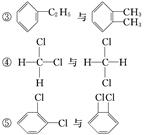
向20 mL AlCl3溶液中滴入2 mol/L NaOH溶液时,得到沉淀的质量与所滴加NaOH溶液的体积有如图关系:
(1)图中A点表示的意义是。
(2)图中B点表示的意义是。
(3)若溶液中有Al(OH)3沉淀0.39 g,则用去NaOH溶液的
体积可能为或毫升。
除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处。
| 试剂 |
离子方程式 |
|
| ①NaHCO3溶液(Na2CO3) |
||
| ②Fe2O3(Al2O3) |
||
| ③FeCl3溶液(FeCl2) |
||
| ④CO2(HCl) |
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
(1)B元素位于元素周期表中第周期,第族。
(2)由元素C与Mg元素形成的化合物的化学键的类型。
(3)由元素A与氢元素形成的化合物的结构式。
(4)由元素B与氢元素形成的化合物的电子式。
(5)写出A的气态氢化物与B的最高价氧化物对应的水化物反应的化学方程式:。