将适量的下列物质,分别投入等质量、等溶质质量分数的稀盐酸中,恰好完全反应后,产生的气体全部逸出,所得溶液中的MgCl2的质量分数最小的是
| A.Mg | B.MgO | C.Mg(OH)2 | D.MgCO3 |
下表是常温下的五种溶液,下列有关叙述中正确的是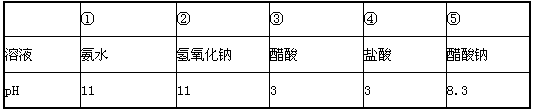
| A.表中五种溶液,其中①~④由水电离出的c(H+):②=④>①=③ |
| B.在⑤中加入适量④至溶液呈中性,所得溶液:c(Cl-)>c(Na+) |
| C.分别将①~④加水稀释至原溶液体积的100倍后溶液的pH:①>②>③>④ |
| D.将①、④两种溶液等体积混合所得溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
在不同温度下,水溶液中c(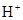 )与c(
)与c( )有如图所示关系,下列有关说法正确的是
)有如图所示关系,下列有关说法正确的是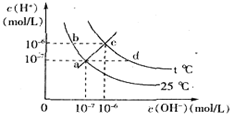
| A.c点对应的溶液中大量存在的离子可能为:Na+、Al3+、Cl-、CO32- |
| B.将25℃时的NaCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 |
| C.t℃>25℃ |
| D.ac线上的任意一点均有pH=7 |
水的电离平衡曲线如图所示,下列说法不正确的是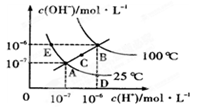
| A.图中五点KW间的关系B>C>A=D=E |
| B.若从A点到D点,可采用在水中加入少量酸的方法 |
| C.若从A点到C点,可用温度不变时在水中加入适量NH4Cl固体的方法 |
| D.若处在B点时,将pH=2的硫酸与pH=l2的KOH等体积混合后,溶液显碱性 |
已知某温度下CH3COOH和NH3•H2O 的电离常数相等,现向10mL浓度为0.1mol•L‾1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
| A.水的电离程度始终增大 |
| B.c(NH4+)/c(NH3•H2O)先增大再减小 |
| C.c(CH3COOH)与c(CH3COO‾)之和始终保持不变 |
| D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO‾) |
下列说法或表述正确的是
A由水电离产生的c(H+)=1×10-2mol•L-1溶液中,可能存在:CO32-、NH4+、Cl-、Na+
B某醋酸稀溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
C Ba(OH)2溶液中加人过量的Al2(SO4)3溶液,其离子方程式为:3Ba2++6OH- +2Al3+ +3SO42-=3BaSO4↓+2Al(OH)3↓
D物质的量浓度均为1 mol•L-1的NaCl和MgCl2混合液中,含有Cl-的数目为3NA(NA表示阿伏加德罗常数的值)