下列表示对应化学反应的离子方程式正确的是( )
| A.向含有Fe2O3悬浊液中通入HI: Fe2O3 + 6H+= 2Fe3+ + 3H2O |
| B.NaHSO4溶液中滴入Ba(OH)2溶液至SO42-完全沉淀:2H++ SO42-+Ba2++2OH—=BaSO4↓+2H2O |
| C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.将1 mol/L NaAlO2溶液和1.5 mol/L HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
下列有关沉淀平衡的说法中正确的是
| A.在AgCl的沉淀溶解平衡体系中加入蒸馏水,Ksp(AgCl)增大 |
| B.在CaCO3的沉淀溶解平衡体系中加入稀盐酸,平衡不移动 |
| C.可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 |
| D.25 ℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成 |
下列关于盐酸与醋酸两种稀溶液的说法正确的是
| A.相同浓度的两溶液中c(H+)相同 |
| B.100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠 |
| C.pH=3的两溶液稀释100倍,pH都为5 |
| D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小 |
下列说法正确的是
| A.原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 |
| B.Fe3+的最外层电子排布式为3s23p63d5 |
C.基态铜原子的最外层的电子排布图: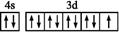 |
| D.所有非金属元素都分布在p区 |
25℃时,向纯水中加入NaOH,使溶液的pH为11,则该溶液中由NaOH电离出的c(OH-)与由水电离出的c(OH-)之比为
| A.108∶1 | B.5×109∶1 | C.1010∶1 | D.1∶1 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O===CH3COOH+4H+。下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.电池反应的化学方程式为CH3CH2OH+O2===CH3COOH+H2O |
| C.正极上发生的反应为:O2+4e-+2H2O===4OH- |
| D.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气 |