下列离子或分子组中能大量共存,且满足相应要求的是 ( )
| 选项 |
离子 |
要求 |
| A |
K+、NO3-、Cl-、HS- |
c(K+)<c(Cl-) |
| B |
Fe3+、NO3-、SO32-、Cl- |
逐滴滴加盐酸立即有气体产生 |
| C |
Na+、HCO3-、Mg2+、SO42- |
逐滴滴加氨水立即有沉淀产生 |
| D |
NH4+、Al3+、SO42-、CH3COOH |
滴加NaOH浓溶液立刻有气体产生 |
下图曲线a表示放热反应 X(g) + Y(g) 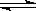 Z(g) + M(g) + N(s)△H <0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g) + M(g) + N(s)△H <0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是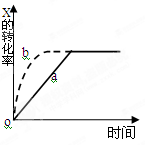
| A.升高温度 | B.加大X的投入量 |
| C.加催化剂 | D.增大体积 |
已知N2+3H2 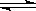 2NH3△H<O ,反应速率为V1;2HI
2NH3△H<O ,反应速率为V1;2HI 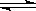 H2+I2△H>O ,反应速率为V2。对于上述两个可逆反应,当升高温度时,V1和V2的变化情况为
H2+I2△H>O ,反应速率为V2。对于上述两个可逆反应,当升高温度时,V1和V2的变化情况为
| A.同时增大 | B.同时减小 |
| C.V1增大,V2减小 | D.V1减小,V2增大 |
一定条件下反应2AB(g) A2(g) + B2(g)达到平衡状态的标志是
A2(g) + B2(g)达到平衡状态的标志是
A、容器内压强不随时间变化 B、容器内,3种气体AB、A2、B2共存
C、容器中各组分的体积分数不随时间变化 D、AB的消耗速率等于A2的消耗速率
在2A+B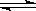 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A、υ(A)= 0.5 mol/(L·s) B、υ(D)= 1 mol/(L·s)
C、υ(C)= 0.8 mol/(L·s) D、υ(B)= 0.3 mol/(L·s)
已知2H2(g)+ O2(g)=2H2O(g)△H= ─484KJ/moL,则反应: H2O(g)= H2(g)+1/2O2(g) 的△H为
| A.─484KJ/moL | B.+484KJ/moL | C.─242KJ/moL | D.+242KJ/moL |