一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质。化学课外兴趣小组的同学决定测定该瓶试剂变质的程度,他们在知识回顾的基础上,依次进行了如下的实验操作:
知识回顾:氢氧化钠必须密封保存;氢氧化钠与二氧化碳反应生成Na2CO3和H2O;CaCO3不溶于水。
第一步:取该瓶中的试剂20g加水配制成溶液;
第二步:向上述溶液中加入足量的稀盐酸,反应产生气体的变化如下图所示:
请根据实验步骤和图像进行分析与计算:
(1)20g试剂与稀盐酸完全反应产生二氧化碳的质量为 g。
(2)计算该20g试剂中含有NaOH的质量分数(结果精确到0.1%)。
(3)如果第二步中改为向第一步配制成溶液中加入足量的澄清石灰水,则生成沉淀的质量为 g。
(4)如果实验测得该瓶试剂中的Na2CO3的质量分数为A,但氢氧化钠的质量分数 却小于(1—A),请你分析可能原因是 。
某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,实验测得相关数据如下图所示:
(1)剩余的混合物中二氧化锰的质量为g,反应生成氧气的质量为g。
(2)计算该过氧化氢溶液中溶质质量分数。
(3)实验表明硫酸铜溶液在该反应中也能起到二氧化锰的作用。若用5.6g无水硫酸
铜代替二氧化锰进行本实验,计算剩余的溶液中溶质的质量分数。(硫酸铜全部溶于水,计算时保留到0.1%)
化学科技小组同学将13.9g含杂质的纯碱样品(碳酸钠与氯化钠的混合物)与90.5g稀盐酸相混合充分反应,测得反应生成气体的质量(m)与反应时间(t)的数据如下表所示:
| 反应时间t/s |
t0 |
t1 |
t2 |
t3 |
t4 |
t5 |
t6 |
| 气体质量m/g |
0 |
0.88 |
1.76 |
2.64 |
3.52 |
4.4 |
4.4 |
根据题目要求,回答下列问题:
(1)请根据表中数据在下面的坐标图中,画出反应是生成气体的质量(m)随时间(t)变化的曲线。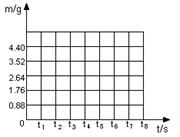
(2)碳酸钠完全反应后,生成CO2的物质的量为mol
(3)求纯碱样品中Na2CO3的质量分数。(Na2CO3+2HCl→2NaCl+CO2↑+H2O)。
请根据下图所示的实验过程和提供的数据(假设过氧化氢和水不挥发),计算:
(1)最后得到的固体的质量为_________g。
(2)过氧化氢溶液中过氧化氢的质量分数。
资料:
①过氧化氢溶液是过氧化氢与水的混合物。
②过氧化氢溶液中过氧化氢的质量分数:

醋酸钾( )是一种融雪效果好、且无污染的融雪剂。请回答:
)是一种融雪效果好、且无污染的融雪剂。请回答:
(1)醋酸钾中C、H、O元素的质量比为_________;
(2)醋酸钾的相对分子质量为_________;
(3)钾元素的质量分数为_________。
某同学取回矿石样品,他对样品中的碳酸钙的质量分数进行检测,方法是:取矿石样品8g,将40g盐酸溶液分四次加入,所得数据如下表(已知石灰石样品中的杂质不溶于水,不与盐酸反应)请计算:
| 序号 |
加入稀盐酸的质量(g) |
剩余固体的质量(g) |
| 1 |
10 |
5.5 |
| 2 |
10 |
m |
| 3 |
10 |
1.2 |
| n |
(1)上表中m的数值;
(2)样品中碳酸钙的质量分数?
(3)要制取4.4g二氧化碳,需含碳酸钙质量分数为80%的石灰石多少克?