近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如下图。下列有关说法肯定错误的是( )
| A.Al2H6在固态时所形成的晶体是分子晶体 |
| B.氢铝化合物可能成为未来的储氢材料和火箭燃料 |
| C.Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| D.Al2H6中含有离子键和极性共价键 |
在反应H2 + Cl2= 2HCl中,已知断开1 mol H-H需要能量436 kJ,断开1 mol Cl-Cl需要能量243 kJ,断开1 mol H-Cl需要能量431 kJ,判断该反应是()。
| A.吸热反应 | B.放热反应 | C.放出832 kJ热量 | D.吸收183 kJ热量 |
实验室准备较快地制取氢气,可采用的方法是()。
| A.用纯锌与稀硫酸反应 | B.用纯锌与稀硝酸反应 |
| C.用粗锌与稀硝酸反应 | D.在CuSO4溶液中浸泡过的纯锌与稀硫酸反应。 |
一定温度下,反应N2(g)+3H2(g)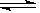 2NH3(g)不能作为达到平衡状态的依据的是( )。
2NH3(g)不能作为达到平衡状态的依据的是( )。
| A.N2,H2和NH3的质量分数不再改变 |
| B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2 |
| C.断开1 mol H-H的同时形成1 mol H-H |
| D.单位时间里每增加1 mol N2,同时消耗3 molH2 |
可逆反应2A(g)+3B(g)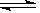 2C(g)+D(g)在四种不同条件下的反应速率分别为:
2C(g)+D(g)在四种不同条件下的反应速率分别为:
①v(A)="0.5" mol/(L·min)②v(B)="0.6" mol/(L·min)
③v(C)="0.35" mol/(L·min)④v(D)="0.4" mol/(L·min)
则该反应在不同条件下反应速率最快的是()
A.① B.② C.③ D.④
某一反应物的浓度是2.0 mol/L,经过4 min后,它的浓度变成了1.68 mol/L,则在这4 min内它的平均反应速率为()。
| A.0.2 mol·L-1·min-1 | B.0.1 mol·L-1·min-1 | C.0.04 mol·L-1·min-1 | D.0.08 mol·L-1·min-1 |