实验测得在常温下0.1mol·L-1某一元碱(BOH)pH≠13,0.1 mol·L-1的某一元酸(HA)溶液中, ,将两种溶液等体积混合后,溶液中离子浓度关系正确的是
,将两种溶液等体积混合后,溶液中离子浓度关系正确的是
A.C(A-)>C(B+)>C(H+)>C(OH-) B.C(B+)>C(A-)>C(H+)>C(OH-)
C.C(B+)>C(A-)>C(OH-)=C(H+) D.C(A-)>C(B+)>C(OH-) >C(H+)
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,11.2 L乙醇所含的羟基数为0.5NA |
| B.常温下,1L 0.1 mol·L-1的Na2CO3溶液中含有的离子总数为0.3NA |
| C.常温常压下,5.6g乙烯和环丙烷的混合气体中含有的碳原子数为0.4NA |
| D.电解硫酸铜溶液时,阳极每生成标准状况下3.36L气体,电路中转移电子数为0.3NA |
三种不同物质有如图所示转化关系:甲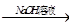 乙
乙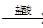 丙
丙 甲,则甲不可能是
甲,则甲不可能是
| A.Al2O3 | B.SiO2 | C.CO2 | D.NH4Cl |
关于下列各实验装置图的叙述中,正确的是
| A.装置①可用于分离苯和溴苯的混合物 |
| B.装置②可用于吸收HCl或NH3气体 |
| C.装置③可用于分解NH4Cl制备NH3 |
| D.装置④b口进气可收集CO2或NO气体 |
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是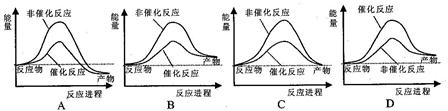
下列有关物质性质的叙述正确的是
| A.浓硫酸能干燥氢气、氯气、一氧化碳等气体,说明浓硫酸具有吸水性 |
| B.SiO2既能溶于NaOH溶液又能溶于HF,说明SiO2是两性氧化物 |
| C.乙炔能使溴水、酸性高锰酸钾溶液褪色,说明乙炔具有漂白性 |
| D.纤维素的水解产物能够发生银镜反应,说明纤维素是一种还原性糖 |