有一种新型的锂电池,其制作是利用了金属锂和石墨作电极,其电解质溶液是四氯合铝酸锂(LiAlCl4)溶解在二氯亚硫酰(其化学式是SOCl2)中形成的,原电池的电极总反应式是:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列关于这种新型电池的说法中错误的是
| A.电池工作过程中,SOCl2被还原为Li2SO3 |
| B.锂作为电池的负极,石墨作电池的正极 |
| C.该电池内环境应该是无水环境,否则影响电池的寿命 |
| D.电池工作时,锂提供的电子的物质的量与析出硫的物质的量之比是4∶1 |
将有机物A 6g,装入元素分析装置,通入足量的O2使它充分完全燃烧,将生成的气体依次通过氯化钙干燥管B和碱石灰干燥管C.测得B管质量增加了3.6g,C管增加了8.8g.且此化合物的质谱图及核磁共振氢谱如图.则对A的叙述正确的是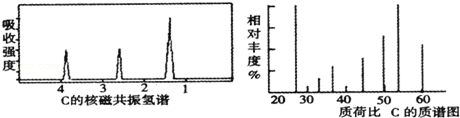
A.分子式为CH2O B.结构简式为CH3COOH
C.结构简式可能为CH2(OH)CHO D.摩尔质量为60
若过程I与过程II温度相同,则关于反应N2O4(g) 2NO2(g)在下列过程中发生的变化描述正确的是
2NO2(g)在下列过程中发生的变化描述正确的是
| A.a'<b'、a>b |
| B.在平衡I向平衡II过渡的过程中,v(逆)<v(正) |
| C.a'>a、b'<b |
| D.平衡II与平衡IV中N2O4的质量分数相等 |
关于下列四个图象的说法中正确的是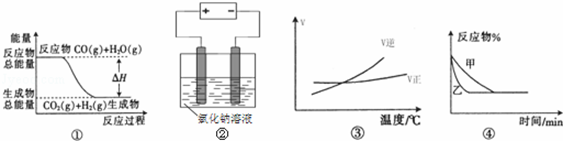
| A.图①表示可逆反应CO(g)+H2O(g)⇌CO2(g)+H2(g)中的△H>0 |
| B.图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1 |
| C.图③表示可逆反应A2(g)+3B2(g)⇌2AB3(g)的△H小于0 |
| D.图④表示压强对可逆反应2A(g)+2B(g)⇌3C(g)+D(s)的影响,乙的压强大 |
在不同温度下,水溶液中c(H+)与c(OH﹣)有如图所示关系.下列条件关于离子共存说法中正确的是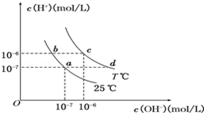
| A.a点对应的溶液中大量存在:Fe3+、Na+、Cl﹣、SO42﹣ |
| B.b点对应的溶液中大量存在:NH4+、Ba2+、OH﹣、I﹣ |
| C.c点对应的溶液中大量存在:Na+、Ba2+、Cl﹣、HCO3﹣ |
| D.d点对应的溶液中大量存在:Na+、K+、SO32﹣、Cl﹣ |