一种充电电池放电时的电极反应为:H2+2OH— 2e—=2H2O NiO(OH) + H2O +e—=Ni(OH)2 + OH—当为电池充电时,与外电源正极连接的电极上发生的反应是( )
2e—=2H2O NiO(OH) + H2O +e—=Ni(OH)2 + OH—当为电池充电时,与外电源正极连接的电极上发生的反应是( )
| A.H2O的还原 | B.NiO(OH)的还原 |
| C.H2的氧化 | D.Ni(OH)2的氧化 |
在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是()
bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是()
| A.a>b | B.平衡向正反应方向移动 |
| C.A的转化率减小 | D.B的质量分数减小 |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:
CO(g)+H2O(g)  CO2(g)+H2(g)ΔH<0
CO2(g)+H2(g)ΔH<0
反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
| A.增加压强 | B.降低温度 | C.增大CO2的浓度 | D.更换催化剂 |
一定条件下,可逆反应C(s)+CO2(g)  2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是( )
2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是( )
| A.①②③④ | B.①③ | C.④② | D.①③④ |
对于可逆反应 A(g) +2B(g)  2C(g)ΔH>0,反应时间t,温度T与平衡混合物中
2C(g)ΔH>0,反应时间t,温度T与平衡混合物中
C的百分含量关系的是()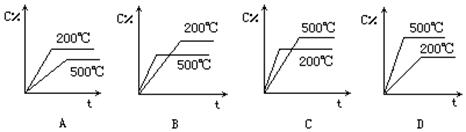
对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是( )
4NO(g)+6H2O(g),下列叙述中正确的是( )
| A.达到化学平衡时4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率的关系是2v正(NH3)=3v正(H2O) |