某化学课外兴趣小组通过查阅资料知道过氧化钠(Na2O2)能与水反应生成氢氧化钠和氧气,于是他们做了以下探究实验。
实验1:向包有过氧化钠粉末的脱脂棉上滴水,脱脂棉燃烧起来。请你对脱脂棉燃烧的原因进行分析_______________________________________________。
实验2:向盛有过氧化钠粉末的试管中加入水,充分反应后,取试管中的少量溶液放入另一小试管中加入几滴无色酚酞试液,溶液变红,过了一会,红色又褪去了。
【提出问题】溶液为什么先变红,过了一会,红色又褪去了呢?
【猜想】甲同学认为是氢氧化钠溶液与空气中的二氧化碳反应的缘故。乙同学认为甲同学的猜想不正确,理由是____ _____ ________。
【查阅资料】①滴加酚酞呈现红色的溶液遇到H2O2时,H2O2可以破坏酚酞的结构,使酚酞在碱性溶液中不能再显红色;②酚酞在稀碱性溶液中稳定显红色,而在浓氢氧化钠等溶液中显红色后又褪色。
【猜想】通过查阅资料后,该兴趣小组对溶液的红色褪去的主要原因进行了猜想。
猜想A:过氧化钠与水反应可能生成了H2O2;猜想B:生成的氢氧化钠溶液可能太浓。
【实验探究】请你将下列实验方案填写完整。
| 猜想 |
实验操作 |
实验现象 |
结论 |
| A |
取过氧化钠与水反应后的溶液放入试管中,_____ ___________________________________________ |
_________________ |
猜想A 正确 |
| B |
取过氧化钠与水反应后的溶液放入试管中, ________________________________________ |
________________ |
猜想B 错误 |
某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ、写出该中和反应的化学方程式:。
Ⅱ、探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2; 猜想二:可能只有CaCl2;
猜想三:。
【查阅资料】氯化钙溶液呈中性。
【进行实验】实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡
实验现象:,结论:猜想一不正确
实验步骤:实验步骤取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量
实验现象:。结论:猜想二不正确,猜想三正确
【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑。
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验?(填序号)
a.pH试纸 b.铜 c.紫色石蕊试液 d.硝酸银溶液
(3)烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是(写一条)。要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的。
假日里,同学们在帮忙老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和成因分析
| 白色粉末的成分 |
形成的原因 |
| 可能是CaCO3 |
石灰水与空气中CO2反应,化学方程式为: |
| 可能是 |
暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质析出 |
经过反复思考,同学们认为白色粉末还可能是 的混合物。
(2)设计实验:甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解,于是他得出粉末中一定有CaCO3的结论。乙同学查阅了溶解性表(如下图),认为甲同学的结论不严密,理由是 。
| OH- |
Cl- |
CO32- |
NO3- |
|
| Ca2+ |
微 |
溶 |
不 |
溶 |
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
| 实验步骤 |
可能观察到的现象 |
结论 |
| 取上述试管中的上层清液,滴加1~2滴无色酚酞试液 |
|
白色粉末中含有Ca(OH)2 |
| 往上述试管内残留的固体中加入足量稀盐酸 |
固体溶解,产生气泡 |
白色粉末中 |
| 由上述实验可知白色粉末的成分是: |
||
(3)交流与反思
通过上述实验的探究,同学们向实验室提出保存、使用易变质的溶液时的下列建议,合理的是_______(填序号)。
A.密封保存 B.使用前,临时配制 C.禁止使用这种试剂
甲、乙、丙、丁四位同学在探究实验时发现了个意外的现象:氢氧化钠溶液中滴入酚酞试液,溶液变成红色,可是过了一会儿红色就消失了。这是什么原因呢?他们依据所学的化学知识,分别对意外现象的成因做了如下猜想:
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应使红色消失;
丁:可能是氢氧化钠溶液的浓度过高引起的。
;
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是:;
(2)丙同学认为乙同学的猜想也不正确,他的理由是
(3)四位同学讨论后认为要验证丙同学的猜想,还需作如下实验,你知道其实验目的吗?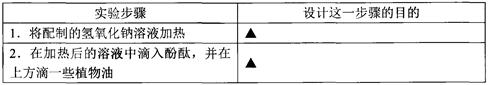
通过以上实验,四位同学观察到的现象是:溶液先变成红色,过了一会儿红色仍然消失。
(4)若丁同学的猜想正确,大家能设计实验证明吗?
现有失去标签的两瓶无色溶液:氯化钠溶液和稀盐酸。某化学探究小组打算用物理和化学两种方法加以区别。请回答:
(1)化学方法:在不选用酸碱指示剂、pH试纸的情况下,按表中方法一(示例)填写。所选试剂须属于不同物质类别(单质、氧化物、酸、碱、盐、有机物等)。
| 所选试剂 |
判别方法 |
|
| 方法一 |
锌 |
取少量样品分别与锌反应,有气体产生的是稀盐酸,没有的是氯化钠溶液。 |
| 方法二 |
||
| 方法三 |
(2)物理方法:同学小王使用了酒精灯和玻璃棒两种仪器,就把这两种无色溶液区分开了。请你猜测一下他的做法:
操作方法:
判断方法:
现代人对生活品质的要求越来越高,食品添加剂也应运而生.
(1)“盐卤点豆腐,一物降一物”这句俗语中的盐卤就是人们为改变食品状态而添加的凝固剂.盐卤的主要成分是氯化镁,海水中含有丰富的食盐和氯化镁,其分离、提纯过程如图所示:
据图回答:粗盐中含有大量泥沙,从粗盐提纯精盐的步骤是 _________ 、 _________ 、 _________ .写出Ⅱ中发生的化学反应方程式 _________ .
(2)能正确看待和安全使用食品添加剂非常重要.下表是某超市售卖的两种不同品牌橙汁的标签.

(i)两种橙汁均属于_________(填“纯净物”或“混合物”).
(ii)你选择的品牌更倾向于:_________ 填“A”或“B”).为防范添加剂的危害,选购包装食品时应注意_________(至少写一条).
(3)为维护食品安全,卫生部公告,自2011年5月1日起,禁止在面粉中添加增白剂等添加剂.有媒体报道面条可以燃烧,一些市民据此担心面条中加入了不安全的添加剂.仅从面条可燃就判断加入了添加剂是不科学的,因为面粉中含有的淀粉是可以燃烧的,淀粉的化学式为(C6H10O50,完全燃烧的产物是___________;燃烧过程中可闻到像头发烧焦似的刺鼻气味,是面粉中的营养素 ___________燃烧产生的.
(4)面粉不仅可以燃烧,一定条件下还会发生爆炸.生产面粉过程中应注意的事项___________(任写一条).