据有关新闻报道,我国自2000年11月16日起,禁止使用含PPA的抗感冒药物。PPA是苯丙醇胺的英文缩写,其结构简式为: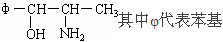
PPA能发汗驱寒,宣肺平喘,主要治疗伤风感冒哮喘、支气管炎等。但PPA能使中枢神经兴奋,导致不安、失眠。服用过量时可引起血压高或中风等。请回答下列问题:
(1)PPA(填“是”或“不是”)芳香烃,它的分子式为: 。
(2)PPA可能具有的性质和可能发生的反应有 (填序号)。
①酯化反应 ②消去反应 ③具有酸性 ④与Br2取代 ⑤加聚
(3)一个碳原子与四个不同原子或基团相连时,就称此碳原子为手性碳原子,如右图中中与溴相连的碳原子。则PPA分子内含有 个手性碳原子。
(4)有机物A、B与PPA的分子式相同,A在一定条件下,可被氧化为苯丙氨酸。则A的结构简式为 ;
B可与FeCl3溶液起显色反应,试写出B的一种结构简式 。
(5)已知:胺可以与NaNO2在催化剂作用下反应生成醇。如: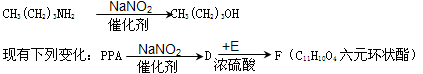
则E物质的名称为 ,F的结构式为 。
写出D与E反应生成六元环状酯化合物的化学方程式:
。
有一瓶无色透明溶液,只含Cl-、CO32-、SO42-、Na+、K+、Mg2+、Cu2+离子中的某几种。经实验:
①取少量原溶液加入足量的Ba(OH)2溶液产生白色沉淀;
②取少量原溶液中加BaCl2溶液不产生沉淀;
③取少量原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。
回答下列问题:
(1)试分析原溶液中一定含有的离子是,一定不含有的离子是,可能含有的离子是。
(2)有的同学认为实验③后面的实验可以省略,你认为是否正确(填“是”或“否”),说明理由。
(3)写出①中反应的离子方程式。
(1)现有以下物质:①NaCl晶体②SO2③稀硫酸④石墨⑤BaSO4固体⑥蔗糖(C12H22O11)⑦酒精⑧熔融的KNO3⑨CaO⑩纯净的醋酸
请回答下列问题(用序号):
以上物质中能导电的是;以上物质中属于电解质的是。
(2)按要求写出下列对应的方程式:
(①电离方程式、②化学方程式、③离子方程式)
①Al2(SO4)3:
②CO2+2OH-=CO32-+H2O:
③NaHCO3与NaHSO4溶液反应:
(1)下列物质中,物质的量最大的是________,含原子个数最多的是________,质量最大的是________。
| A.3gH2; | B.标况下33.6LCO2; | C.1.204×1024个HCl分子; | D.49gH2SO4;E.46g乙醇(C2H5OH);F.4℃时10mL水 |
(2)在一定条件下,32gA和22gB恰好反应生成C和9gD,在相同条件下,8gA和足量B反应生成D和0.125molC,从上述事实可推知C的摩尔质量为。
有X、Y、Z三种元素,已知:①X、Y、Z的单质在常温下均为气体;②X单质可在Z单质中燃烧,生成气态XZ;③XZ极易溶于水,电离出X+和Z-,其水溶液可使蓝色石蕊试纸变红;④每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为无色液体;⑤Z单质溶于X2Y中,所得溶液具有漂白作用。
(1)推断X,Y两种元素:X________,Y_________(填元素名称)。
(2)写出⑤过程中的化学反应的方程式。
(3)写出工业上制取Z单质的化学方程式。
(4)写Z单质与石灰乳反应的化学方程式 。
(1)①现有11g由 和
和 组成的水分子的物质的量mol,其中含中子数为mol,电子数为个。
组成的水分子的物质的量mol,其中含中子数为mol,电子数为个。
②请画出 2-微粒的结构示意图:。
2-微粒的结构示意图:。
(2)质量相等的两种物质SO2和SO3,两种物质中硫元素质量之比为,分子物质的量之比为,所含氧原子个数之比为。
(3)0.2L 0.5mol/L Al2(SO4)3溶液和0.5L 0.5mol/L Al2(SO4)3溶液所含SO42—离子浓度之比为____________,SO42—离子数目之比为____________。
(4)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为,则含R 8.0g 的NaR的物质的量为mol 。
(5)实验室用二氧化锰与浓盐酸反应制取氯气,反应方程式如下:
MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有mol HCl被氧化,转移电子的物质的量为mol,产生的Cl 2在标准状况下的体积为L。
MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有mol HCl被氧化,转移电子的物质的量为mol,产生的Cl 2在标准状况下的体积为L。