生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O  Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是
Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是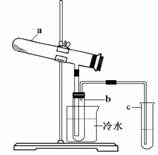
| A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4 |
| B.b中产物用紫色石蕊试液即可检验出其中H+和SO42— |
| C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液 |
| D.b中所得到的硫酸的质量分数为29.5% |
将分别盛有硝酸银溶液、氯化铜溶液和熔融氧化铝(混有Na3AlF6)的三个电解槽串联,在一定条件下通电一段时间后,析出银、铜、铝的物质的量之比为()
| A.1:2:3 | B.3:2:1 | C.6:3:2 | D.6:3:1 |
用惰性电极电解100 mL饱和食盐水,一段时间后在阴极得到112 mL H2(标准状况),此时电解液(体积变化忽略不计)的pH为( )
| A.13 | B.12 | C.8 | D.1 |
4 mL O2和3 mL NxHy(y>x)的混合气体在120 ℃、1.01×105 Pa条件下充分反应,恢复到原来的温度和压强时,测得混合气体(N2、O2、H2O)的密度比原来减少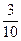 。
。
(1)写出其反应的化学方程式。
(2)推算NxHy的化学式。
取A、B、C三种金属各0.1 mol,分别与足量的盐酸反应,在标准状况下,共生成6.72 L氢气。又知B、C所产生的氢气的体积比是2∶1,且两者产生氢气的体积之和跟A产生的氢气相等。则在氯化物中A元素的化合价为( )
A.+1 B.+2 C.+3 D.+4
用向上排空气法在容积为V mL的集气瓶中收集HCl,收集后瓶内气体的密度是相同条件下He密度的8.75倍。将此集气瓶倒置于水中,瓶内水面上升到一定高度后立即停止上升,则同温同压下,瓶内剩余气体的体积为( )
| A.V/4 mL | B.V/5 mL | C.V/6 mL | D.无法判断 |