(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水放出热量,1558.3 kJ。写出该反应的热化学方程式 。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为 极(填写“正”“负”)该电极上发生的电极反应式是
(3)右图所示实验装置中,石墨棒上的电极反应式为 ;如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 __________(填物质名称)。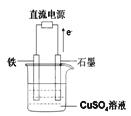
据2014年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子。
(1)下列有关O4的说法正确的是:
| A.O4分子内存在极性共价键 |
| B.合成O4的反应可看作核聚变反应,即不属于化学变化 |
| C.O4与O3、O2都是氧的同素异形体 |
| D.O4不可用作氧化剂 |
(2)制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
(3)写出O22—的电子式:
(4)O2[PtF6]是一种含有O2+的化合物,请写出一种含有O2-的氧化物的化学式:______________。
为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取ag样品,向其中加入足量的NaOH溶液,测得生成气体的体积(标准状况,下同)为b L 。反应的离子方程式为 。样品中铝的质量为 g。
(2)若使ag样品恰好完全反应,则反应中氧化铁与铝的质量比是 ,化学方程式为 。
(3)待(2)中生成物冷却后,加入足量盐酸,测得生成的气体体积为cL,该气体与(1)中所得气体的体积比c:b = 。
向浓度相等、体积均为50 mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100 mL。在稀释后的溶液中逐滴加入0.1 mol/L的盐酸,产生CO2的体积 (标准状况)与所加盐酸的体积关系如右图所示。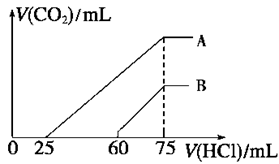
① A曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是__________mL(标准状况);
②B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为____________,物质的量之比为 ;
③原NaOH溶液的物质的量浓度为__________。
将过量的铜置入一定量的浓硝酸中,充分反应后放出11.2 L气体(标准状况下),试回答下列问题:
(1)反应放出的气体中,含有 (写化学式);
(2)写出反应过程中的的化学方程式: ;
(3)若有19.2g铜溶解,则参加反应的HNO3的物质的量 被还原HNO3的质量为
Ⅰ、碳元素是日常生活中接触非常多的一种元素,回答下列问题。
(1)用化学方程式表示溶洞生成的反应原理: 。
(2)可用稀盐酸来鉴别Na2CO3和NaHCO3溶液,现将稀盐酸慢慢滴入碳酸钠溶液中,请写出开始阶段发生反应的离子方程式 。
(3)写出用小苏打来治疗胃酸过多时发生反应的离子方程式: 。
II、氮元素在生命活动中扮演着重要的角色,回答下列与氮及其化合物有关的问题:
(1)德国化学家哈伯、波施等科学家成功地开发了将氮气转化为氨气的生产工艺。请用化学方程式表示工业合成氨的反应原理: 。
写出在氨气的出气口处,检验有氨气生成的操作:
(2)将氨气通入酚酞溶液中,酚酞溶液变成红色。请用方程式解释原因: 。
Ⅲ、印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”溶解铜。
(1)写出该反应的离子方程式: ;
(2)从使用过的腐蚀液中可以回收金属铜,下列试剂能实现的是 (填序号)
| A.氯气 | B.铁 | C.硝酸 | D.稀硫酸 |
(3)向使用过的腐蚀液中通入Cl2,可使Fe2+转化为Fe3+,写出反应的离子方程式 。