工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
(1)4FeO·Cr2O3 + 8Na2CO3 + 7O2  8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2
(2)2Na2CrO4 + H2SO4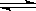 Na2SO4 + Na2Cr2O7 + H2O
Na2SO4 + Na2Cr2O7 + H2O
下列说法正确的是
| A.反应(1)和(2)均为氧化还原反应 |
| B.反应(1)的氧化剂是O2,还原剂是FeO·Cr2O3 |
| C.高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4 |
| D.反应(1)中每生成1molNa2CrO4时电子转移3mol |
在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是
| A.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ |
| B.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+、Fe2+ |
| C.在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:KOH、Ba(OH)2、BaCO3、K2CO3 |
| D.在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32- |
设NA为阿伏加德罗常数,下列说法中正确的是
| A.O2和O3的混合气体共6.4g,其中所含氧原子数一定为0.4NA |
| B.将标准状况下22.4LNO与11.2LO2混合后的体积约为22.4L |
| C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA |
| D.标准状况下11.2LCl2溶于1L水中,转移电子的数目为0.5NA |
在一个不导热的密闭反应器中,只发生两个反应:
;
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是()
| A. | 等压时,通入惰性气体, 的物质的量不变 |
| B. | 等压时,通入 气体,反应器中温度升高 |
| C. | 等容时,通入惰性气体,各反应速率不变 |
| D. | 等容时,通入 气体, 的物质的量浓度增大 |
肼( )是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1 化学键所需的能量( ): 为942、 为500、 为154,则断裂1 N﹣H键所需的能量( )是()
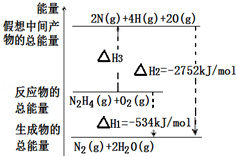
| A. | 194 | B. | 391 | C. | 516 | D. | 658 |
向10 0.1 ﹣1 溶液中,滴加等浓度 溶液 .下列叙述正确的是()
| A. | 时,溶液中有 、 、 ,且 ( ) ( ) |
| B. | 时,溶液中有 、 、 ,且 ( ) ( ) |
| C. | 时,溶液中有 、 、 ,且 ( ) ( ) |
| D. | 时,溶液中有 、 、 ,且 ( ) ( ) |